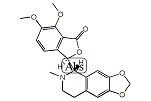
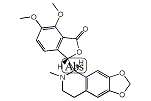
| その他の名称: | (3R)-6,7-Dimethoxy-3-[[(1S)-1,2,3,4-tetrahydro-2-methyl 6,7-(methylenedioxy)isoquinoline]-1-yl]isobenzofuran-1(3H)-one、(3R)-6,7-Dimethoxy-3-[(5S)-6-methyl-5,6,7,8-tetrahydro-1,3-dioxolo[4,5-g]isoquinoline-5-yl]isobenzofuran-1(3H)-one、(+)-β-ヒドラスチン、(+)-β-Hydrastine、(1S)-1β-[3(1H)-Oxo-4,5-dimethoxyisobenzofuran-1α-yl]-1,2,3,4-tetrahydro-2-methyl 6,7-(methylenebisoxy)isoquinoline、(3R)-6,7-Dimethoxy-3-[(5S)-5,6,7,8-tetrahydro-6-methyl-1,3-dioxolo[4,5-g]isoquinoline-5-yl]-1(3H)-isobenzofuranone、(+)-Hydrastine、(+)-ヒドラスチン |
| 体系名: | (3R)-6,7-ジメトキシ-3-[[(1S)-1,2,3,4-テトラヒドロ-2-メチル6,7-(メチレンジオキシ)イソキノリン]-1-イル]イソベンゾフラン-1(3H)-オン、(3R)-6,7-ジメトキシ-3-[(5S)-6-メチル-5,6,7,8-テトラヒドロ-1,3-ジオキソロ[4,5-g]イソキノリン-5-イル]イソベンゾフラン-1(3H)-オン、(1S)-1β-[3(1H)-オキソ-4,5-ジメトキシイソベンゾフラン-1α-イル]-1,2,3,4-テトラヒドロ-2-メチル6,7-(メチレンビスオキシ)イソキノリン、(3R)-6,7-ジメトキシ-3-[(5S)-5,6,7,8-テトラヒドロ-6-メチル-1,3-ジオキソロ[4,5-g]イソキノリン-5-イル]-1(3H)-イソベンゾフラノン |