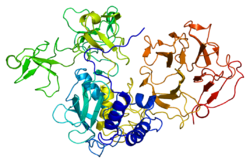
マトリックスメタロプロテイナーゼ-2
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2024/04/09 13:18 UTC 版)
- ^ a b c GRCh38: Ensembl release 89: ENSG00000087245 - Ensembl, May 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000031740 - Ensembl, May 2017
- ^ Human PubMed Reference:
- ^ Mouse PubMed Reference:
- ^ “Structure and expression of neutrophil gelatinase cDNA. Identity with type IV collagenase from HT1080 cells”. J. Biol. Chem. 267 (35): 25228–32. (December 1992). doi:10.1016/S0021-9258(19)74029-0. PMID 1460022.
- ^ “MMP2 gene”. Genetics Home Reference. 2015年5月19日閲覧。
- ^ “MMP2 matrix metallopeptidase 2 [Homo sapiens (human) - Gene - NCBI]” (英語). www.ncbi.nlm.nih.gov. 2024年3月25日閲覧。
- ^ Itoh, Yoshifumi; Seiki, Motoharu (2004-06). “MT1-MMP: an enzyme with multidimensional regulation”. Trends in Biochemical Sciences 29 (6): 285–289. doi:10.1016/j.tibs.2004.04.001. ISSN 0968-0004. PMID 15276180.
- ^ “Mutation of the matrix metalloproteinase 2 gene (MMP2) causes a multicentric osteolysis and arthritis syndrome”. Nature Genetics 28 (3): 261–5. (July 2001). doi:10.1038/90100. PMID 11431697.
- ^ a b “Multicentric Osteolysis, Nodulosis, and Arthropathy in two unrelated children with matrix metalloproteinase 2 variants: Genetic-skeletal correlations”. Bone Reports 15: 101106. (December 2021). doi:10.1016/j.bonr.2021.101106. PMC 8283316. PMID 34307793.
- ^ “Characteristic elevation of matrix metalloproteinase activity in idiopathic interstitial pneumonias”. American Journal of Respiratory and Critical Care Medicine 162 (5): 1949–56. (November 2000). doi:10.1164/ajrccm.162.5.9906096. PMID 11069839.
- ^ “Matrix metalloproteinases vary with airway microbiota composition and lung function in non-cystic fibrosis bronchiectasis”. Annals of the American Thoracic Society 12 (5): 701–7. (May 2015). doi:10.1513/AnnalsATS.201411-513OC. PMID 25679336.
- ^ “A novel microbiota stratification system predicts future exacerbations in bronchiectasis”. Annals of the American Thoracic Society 11 (4): 496–503. (May 2014). doi:10.1513/AnnalsATS.201310-335OC. PMID 24592925.
- ^ “Clinical and mutation profile of multicentric osteolysis nodulosis and arthropathy”. American Journal of Medical Genetics. Part A 170A (2): 410–417. (February 2016). doi:10.1002/ajmg.a.37447. PMID 26601801.
- ^ a b c “Gelatinase-mediated migration and invasion of cancer cells”. Biochimica et Biophysica Acta (BBA) - Reviews on Cancer 1755 (1): 37–69. (May 2005). doi:10.1016/j.bbcan.2005.03.001. hdl:10138/22049. PMID 15907591.
- ^ a b c d “The role of gelatinases in colorectal cancer progression and metastasis”. Biochimica et Biophysica Acta (BBA) - Reviews on Cancer 1705 (2): 69–89. (December 2004). doi:10.1016/j.bbcan.2004.09.006. PMID 15588763.
- ^ “The regulation of MMP targeting to invadopodia during cancer metastasis”. Frontiers in Cell and Developmental Biology 3: 4. (2015). doi:10.3389/fcell.2015.00004. PMC 4313772. PMID 25699257.
- ^ “Cortactin is an essential regulator of matrix metalloproteinase secretion and extracellular matrix degradation in invadopodia”. Cancer Research 67 (9): 4227–35. (May 2007). doi:10.1158/0008-5472.CAN-06-3928. PMID 17483334.
- ^ “Roles of matrix metalloproteinases in cancer progression and their pharmacological targeting”. The FEBS Journal 278 (1): 16–27. (Jan 2011). doi:10.1111/j.1742-4658.2010.07919.x. PMID 21087457.
- ^ a b “Matrix metalloproteinases: multifunctional contributors to tumor progression”. Molecular Medicine Today 6 (4): 149–56. (April 2000). doi:10.1016/s1357-4310(00)01686-5. PMID 10740253.
- ^ “Integrin alpha v beta 3 rescues melanoma cells from apoptosis in three-dimensional dermal collagen”. Proceedings of the National Academy of Sciences of the United States of America 91 (19): 8856–60. (September 1994). Bibcode: 1994PNAS...91.8856M. doi:10.1073/pnas.91.19.8856. PMC 44705. PMID 7522323.
- ^ “Induction of cell migration by matrix metalloprotease-2 cleavage of laminin-5”. Science 277 (5323): 225–28. (July 1997). doi:10.1126/science.277.5323.225. PMID 9211848.
- ^ “Matrix metalloproteinase-2 governs lymphatic vessel formation as an interstitial collagenase”. Blood 119 (21): 5048–56. (May 2012). doi:10.1182/blood-2011-12-400267. PMID 22490679.
- ^ “TGFbeta in Cancer”. Cell 134 (2): 215–30. (July 2008). doi:10.1016/j.cell.2008.07.001. PMC 3512574. PMID 18662538.
- ^ “Matrix metalloproteinase-9 triggers the angiogenic switch during carcinogenesis”. Nature Cell Biology 2 (10): 737–44. (October 2000). doi:10.1038/35036374. PMC 2852586. PMID 11025665.
- ^ “Expression of MMP-2 correlates with increased angiogenesis in CNS metastasis of lung carcinoma”. International Journal of Clinical and Experimental Pathology 3 (8): 775–81. (2010). PMC 2993228. PMID 21151391.
- ^ “Inflammation dampened by gelatinase A cleavage of monocyte chemoattractant protein-3”. Science 289 (5482): 1202–6. (August 2000). Bibcode: 2000Sci...289.1202M. doi:10.1126/science.289.5482.1202. PMID 10947989.
- ^ a b “Thrombospondin type 1 repeats interact with matrix metalloproteinase 2. Regulation of metalloproteinase activity”. J. Biol. Chem. 275 (41): 32167–73. (October 2000). doi:10.1074/jbc.M003834200. PMID 10900205.
- ^ “Structural insight into the complex formation of latent matrix metalloproteinase 2 with tissue inhibitor of metalloproteinase 2”. Proc. Natl. Acad. Sci. U.S.A. 99 (11): 7414–9. (May 2002). Bibcode: 2002PNAS...99.7414M. doi:10.1073/pnas.102185399. PMC 124245. PMID 12032297.
- ^ “Domain interactions in the gelatinase A.TIMP-2.MT1-MMP activation complex. The ectodomain of the 44-kDa form of membrane type-1 matrix metalloproteinase does not modulate gelatinase A activation”. J. Biol. Chem. 275 (50): 39497–506. (December 2000). doi:10.1074/jbc.M005932200. PMID 10991943.
- ^ a b “Specific, high affinity binding of tissue inhibitor of metalloproteinases-4 (TIMP-4) to the COOH-terminal hemopexin-like domain of human gelatinase A. TIMP-4 binds progelatinase A and the COOH-terminal domain in a similar manner to TIMP-2”. J. Biol. Chem. 272 (24): 15496–500. (June 1997). doi:10.1074/jbc.272.24.15496. PMID 9182583.
- ^ a b “Utilization of a novel recombinant myoglobin fusion protein expression system to characterize the tissue inhibitor of metalloproteinase (TIMP)-4 and TIMP-2 C-terminal domain and tails by mutagenesis. The importance of acidic residues in binding the MMP-2 hemopexin C-domain”. J. Biol. Chem. 277 (50): 48696–707. (December 2002). doi:10.1074/jbc.M209177200. PMID 12374789.
- 1 マトリックスメタロプロテイナーゼ-2とは
- 2 マトリックスメタロプロテイナーゼ-2の概要
- 3 機能
- 4 関連文献
- 5 外部リンク
- マトリックスメタロプロテイナーゼ-2のページへのリンク