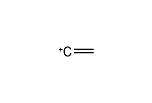エテニウム
エテニウム
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2025/11/16 00:48 UTC 版)

5)
エテニウム(英語: Ethenium)は、化学式C2H+
5で表されるカチオンである。プロトン化エチレンとも呼ばれる。エチレンC2H4にプロトンH+を1つ加えた分子、あるいはエタンC2H6からヒドリドイオンH−を1つ除いた分子とみなすことができる。カルボカチオンの一つであり、非古典的カルボカチオンに分類される。
合成
エテニウムは、放射線を曝された希薄な気体中で観測される[1]。また、プロトン化水素分子H+
3や水素化ヘリウムイオンHeH+、ジアゼニリウムN2H+、N2OH+などのプロトン供与体とエタンを常温・低圧(1 mmHg未満)条件下において反応させることでも得られる。なお、メタニウムCH+
5やHCO+などを用いると、エテニウムよりもエタニウムを生成する可能性がある[2]。
常温の希薄なメタン気体中では、エタニウムは緩やかに解離し、エテニウムとH2を生成する。90 ℃においては、より速く反応する[1]。
安定性と反応
一部の初期の報告とは対称的に、プロペニウムsec-C3H+
7、H2を生成する反応は発熱反応であると考えられているものの、エテニウムは常温・低圧(約1 mmHg)において中性メタンに対してほとんど反応を起こさないことが判明した[3]。
構造
基底状態のエテニウムの構造は、長らく議論の対象となっていたが、最終的には2つの炭素原子と1つの水素原子が三中心二電子結合を形成している非古典的イオン構造をとるとされた。計算により、プロピルカチオンまたはn-ブチルカチオンなどの同族体も架橋構造を持つことが示されている。一般的に、架橋構造は第一級カルボカチオンを安定化させるための手段であると考えられており、古典的な構造を持つ真の第一級カルボカチオンは稀であるか存在しない可能性がある。
脚注
- ^ a b Margaret French and Paul Kebarle (1975), "Pyrolysis of C2H+
7 and other ion-molecule reactions in methane containing traces of ethane". Canadian Journal of Chemistry, volume 53, pages 2268-2274. doi:10.1139/v75-318 - ^ G. I. Mackay, H. I. Schiff, D. K. Bohme (1981), "A room-temperature study of the kinetics and energetics for the protonation of ethane" Canadian Journal of Chemistry, volume 59, issue 12,pages 1771-1778. doi:10.1139/v81-265
- ^ F. H. Field , M. S. B. Munson (1965), "Reactions of gaseous ions. XIV. Mass spectrometric studies of methane at pressures to 2 Torr". Journal of the American Chemical Society, volume 87, issue 15, pages 3289–3294 doi:10.1021/ja01093a001
- エテニウムのページへのリンク