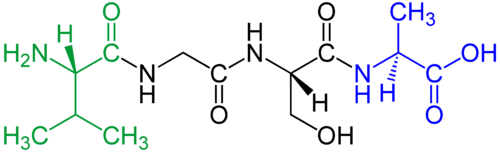
C末端
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2017/11/10 13:16 UTC 版)
ナビゲーションに移動 検索に移動化学
それぞれのアミノ酸はカルボキシル基とアミノ基を持っており、脱水縮合(Dehydration reaction)でアミノ基とカルボキシル基が次々繋がって鎖状を呈している。ポリペプチド鎖はその両末端に、カルボキシル基のC末端とアミノ基のN末端を持っている。タンパク質の合成はN末端から始まりC末端で終わる。
作用
C末端標的シグナル
たいていのタンパク質はN末端に標的シグナルを含んでいるが、C末端にタンパク質の仕分けのためのシグナルをもつものがある。よく知られている小胞体残留シグナルは、C末端にあるアミノ酸配列-KDEL(または-HDEL)であり、これによりタンパク質は分泌経路へ進むことを妨げられ小胞体に保持される。
C末端修飾
タンパク質のC末端には翻訳後修飾が行われることがある。一般に見られるものはC末端への脂質アンカーの付加であり、これによりタンパク質は膜貫通ドメインなしに細胞膜に挿入される。
- プレニル化反応(Prenylation)
- C末端の修飾の一つにプレニル化反応がある。これはファルネシル(またはゲラニルゲラニル)イソプレノイド膜アンカーが、C末端の近くのシステイン残基に付加される。膜結合型のGタンパク質はたいていこの方法で修飾される。
- GPIアンカー
- 他のC末端修飾ではホスホグリカンの一種、グリコシルホスファチジルイノシトール(GPI)が細胞膜アンカーとして付加される。GPIはC末端のプロペプチドがプロテアーゼにより切断された後に結合する。この修飾型の著名な例としてプリオンがある。
C末端ドメイン
C末端ドメイン(CTD)に特別な機能があるタンパク質もある。
- RNAポリメラーゼ
- RNAポリメラーゼIIのC末端ドメインは、Tyr-Ser-Pro-Thr-Ser-Pro-Ser配列の52回の繰り返しで構成される[1]。このC末端ドメインにはしばしばポリメラーゼを活性化するタンパク質が結合する。転写を開始し、mRNAにキャップを付加し、スプライシングのためのスプライセオソームに結合するのに関与するドメインである。[2]。
脚注
| ||||||||||||||||||||||||||||||
- 1 C末端とは
- 2 C末端の概要
C末端と同じ種類の言葉
- C末端のページへのリンク