赤血球
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2024/03/27 02:34 UTC 版)
人工赤血球
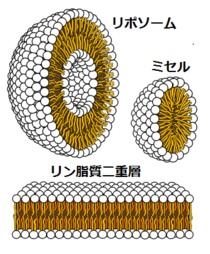
大怪我などで大量に出血すると人は生命の危険があり、緊急に輸血を行わないとならないが、血液はいつどこでも十分な量を確保できるとは限らない。そのため、救急用に人工赤血球の開発の必要は昔から指摘されていた。古くは欧米にてヘモグロビンを加工したものを血液に流せないか研究が進められていたが、剥き出しのヘモグロビンの毒性[注 26]を除去することは困難であり、1製品が南アフリカで承認されたものの安全性と有用性に疑問が持たれ主要国では実用化の目途は立っていない。そのため、現在ではヘモグロビンを内包した小胞体の開発が行われている[118][119][120]。
リン脂質分子は自発的に二重層、あるいはリポソーム、ミセルの形状に並ぶので、リポソームの内側にヘモグロビンを封入すれば酸素運搬能力を持たせることができ、またヘモグロビンの毒性も閉じ込めることができる[119][120]。
2010年現在では赤血球の数十分の一の大きさ(直径数百ナノメートル程度)のリポソーム内に(輸血に使用されなかった廃棄血液から抽出した)ヘモグロビンを封入したヘモグロビン小胞体が動物実験で短期的には効果を認められるところまで開発が進んでいる[119][121]。
脚注
注釈
- ^ 血液の55%程度を占める血漿はやや黄色を帯びてはいるがほとんど透明であり、血液の色は主に45%程度を占める赤血球の色である。
- ^ 基準値の設定は研究機関・検査施設ごとに違う
- ^ ヒトでは安静時に心臓は4-8L/分の血液を拍出し-出典、寺野『シンプル内科学』p.110-人の体内の血液はおよそ3.5-5Lなので血液は平均しておよそ1分弱で体内を巡ることになる。1日で2000回前後、120日では20-30万回程度になる。
- ^ 造血幹細胞を源とし、完成形を赤血球とすると、造血幹細胞から赤血球への分化・成熟の途中段階である。
- ^ 短距離走などの激しい運動をしている筋肉では組織内の酸素分圧は一気に 5mmHg 程度に下がる。この酸素分圧レベルになると筋肉組織内のミオグロビンが蓄えていた酸素を放出して一時的に賄うがミオグロビンは酸素に対する親和性がヘモグロビンより高いので通常の組織内の酸素分圧レベル 20mmHg 以上では酸素を供給することはできない。
- ^ リン脂質二重層の厚さに関しては文献によって異なり、浅野『三輪血液病学』p.129では 7.5nm、H. Lodish, 他 著『分子細胞生物学』p381では 3.5-5.6nm、日本検査血液学会編『スタンダード検査血液学』では 8nm、浅島『図解分子細胞生物学』では 3-5nm など様々である。これは膜に存在するタンパク質の厚さも影響していると思われる。タンパク質を考慮しない脂質二重層のみの厚さは3-6nmの範囲と思われる。ここでは『分子細胞生物学』の数字を挙げた。
- ^ スペクトリンの結合・連結には4.1タンパク (Band4.1) やアクチン (Actin) が関わり、結合部には他に4.2タンパク・4.9タンパク・アデューシンなどのタンパク質が見られるが、4.2タンパク・4.9タンパク・アデューシンの役割は不明である-出典、日本生化学会『新生化学実験講座6』(上)p405-408
- ^ 血液細胞はヘモグロビン以外の物質は無色半透明であり、そのままでは顕微鏡を用いても細胞の様子を見ることはできない。そのために細胞に染色をして特徴を見やすくする。染色の方法は目的によって様々であるが、一般的なライトギムザあるいはメイギムザ染色は二重染色であり、塩基性色素が DNA や RNA, 細胞質のアズール顆粒などを青色に染め、エオジン色素がヘモグロビンや好酸性顆粒を赤橙色に染めるが、若い赤芽球では細胞質が塩基性色素で特に青色が強く染まり、ヘモグロビンが作られ始めた多染性赤芽球では細胞質の青が弱くなってヘモグロビンを染める赤が加わって「多染」となり、さらにヘモグロビンが増えた正染性赤芽球では赤が強くなり細胞質の青色は分からなくなる。
- ^ 成人のヘモグロビン (HbA) は2本のポリペプチドα鎖グロビンと2本のポリペプチドβ鎖グロビンからなる四量体 (α2β2) であるが、人のグロビンには α鎖と β鎖の他に、γ鎖、δ鎖、ε鎖、ζ鎖がある。α鎖とζ鎖の遺伝子は16番染色体上に並び、ζ鎖は胚期初期にのみ発現する。胎生期の大部分と出生後は α鎖のみが発現する。11番染色体上ではグロビン遺伝子は ε鎖、γ鎖、δ鎖およびβ鎖の順に並びスイッチングが起きて発現するグロビンが変化する。胚性ヘモグロビンは α2ε2, ε4, ζ2ε2, ζ2γ2 などであるが、グロビン遺伝子のスイッチングで ε鎖、ζ鎖はまもなく作られなくなり、次に作られる胎児型ヘモグロビンHbF は α2γ2 であるが、出生に近づくとγ鎖も次第に減っていき、出生後にはヘモグロビンの大半を占める α2β2 の HbA と少数の α2δ2 からなる HbA2 に置き換わっていく。-出典 三輪『赤血球』1998年、pp.114-118および野村『赤血球』1994年、pp.22-24
- ^ 研究機関・検査施設ごとに多少の基準値設定の差はある。
- ^ 赤血球の120日の寿命の間中に赤血球内のヘモグロビンはグルコース(血糖)と結びついていくが、その反応は緩徐的(ゆっくり)で非酵素反応のため、一時的なグルコース濃度の変化やグルコース以外の要素の影響を受けにくく、Hb 中の HbA1c の割合は過去1 - 3か月のグルコース濃度(血糖値)の平均に相関することが分かっている。血中にはグルコースは必ずあるため健康人でもヘモグロビンの4.3%-5.8%は HbA1c であるが、血中の血糖値が長期間の平均で高いほど HbA1c も高値になり、糖尿病では6.5%以上の高値になる日本薬学会・HbA1c、糖尿病教室 2011.05.12閲覧
- ^ 数値は文献によって微妙に違い岡田泰伸監訳『ギャノング生理学23版』p.613では0.5%がギリギリの濃度で0.35%ですべて溶血するとし、杉晴夫編著『人体機能生理学』p.305では0.48%で溶血し始め、0.33%で完全に溶血するとしている
- ^ ただし、実際には正常な血液が採血後に採血管の中で溶血し高カリウム血症状態になることが多く、それを偽性高カリウム血症と言い、この場合は体を流れている血液が高カリウム血症であるわけでないので心配要らないことが多い。急激な上昇や腎疾患でない限り過剰なカリウムは迅速に排出されるが、しかし、原因がはっきりするまでは高カリウム血症は要注意である。また輸血用の血液製剤に含まれる赤血球はある程度は必然的に壊れ、輸血用赤血球製剤は高カリウム状態である。輸血量が多いと一時的に高カリウム血症となるため、急激な輸血は注意が必要である。
- ^ 鎌状赤血球症は遺伝疾患であり、その遺伝子を持つものは本来は生存競争に不利であるが、鎌状赤血球症の赤血球はマラリアに抵抗性がある。そのため、マラリアの流行地では鎌状赤血球症の遺伝子を持つものが淘汰されずに現代に残っていると考えられている。
- ^ 多血症も大きく分けると3パターンある。
- 赤血球の絶対量は増加していないのだが、血漿が減少するために血液単位量あたりの赤血球量が相対的に増える、脱水やストレス多血症などの相対的多血症
- 喫煙者でタバコの煙にふくまれる一酸化炭素がヘモグロビンに強力に結びついてヘモグロビンの機能が低下し酸欠状態になる常習的喫煙者や肺機能障害、酸素の薄い高地での生活、これらは慢性的な酸欠をもたらし、酸欠に反応して腎臓でのエリスロポエチンの産出が増加することで多血症が起きる。あるいはエリスロポエチン産出細胞が腫瘍性の増加をすることで起きる多血症もある。これらの多血症はエリスロポエチン量の増加に赤芽球が反応した多血症である。
- 真性多血症などの造血細胞の腫瘍性疾患で赤血球が増えることもある。腫瘍性の増加では腎臓はエリスロポエチンの産出を抑え赤血球数のコントロールを試みるが、腫瘍性の造血細胞はもはやエリスロポエチン量によるコントロールを受け付けず、血中のエリスロポエチン量が低値にもかかわらず赤血球は増加を続ける。
- ^ 例外としてコアラでは赤血球の4から40%程度が核を持つ-Nemi『最新・獣医血液学』p.71。
- ^ 1928年までは英米でもラクダ科の赤血球は有核であるとの誤解はあったが、1928年以降にはその誤解は解消している。しかし日本ではその後も何故かラクダ科の動物の赤血球には核があるとの俗説が信じられて書籍にも載り続けている。それらの俗説は実際にラクダの赤血球を観察したものではなく伝聞で書かれているものである。実際にはラクダ科の動物の赤血球も無核である。-山崎英雄「ラクダの赤血球は有核か?」『生物の科学 遺伝』40巻8号、裳華房、1986年、p.78-79を参照、および出典-越田『比較動物学』p.56。ラクダ科の動物の赤血球には核があるとの誤説は広辞苑第5版などにあるが、広辞苑第6版以降は訂正されている。-中山裕之『獣医学を学ぶ君たちへ』東京大学出版会、2019年、p.32
- ^ ただし、哺乳類の赤血球の構造は血液学的にはどれも似ているが、生化学的には、細胞膜のリン脂質の組成は種によって異なり、マウスではホスファチジルコリン (PC) はヒトより多くスフィンゴミエリン (SM) は少ない。逆にウシでは PC はなく SM はヒトより多い。脂質組成の差は膜の透過性に影響する。-水上『赤血球の生化学』p.96
- ^ 鳥類の赤血球の大きさは 10.7µm × 6.1µm から 15.8µm × 10.2µm 程度であり、ヒトの赤血球の直径 7-8µm より若干大きめである。-Terry W『鳥類とエキゾチックアニマルの血液学、細胞診』p.8- ただし、シジュウカラの仲間カロライナチカディのように1µm程度の極小さい赤血球を持つ例外もいる-越田『光学顕微鏡でみる比較動物学』p.58-59
- ^ 極めて古い1954年の資料ではあるが、百万とも、あるいはそれ以上とも言われる無脊椎動物全種の中で赤血球を持っている種の数を100種程度としている。-出典 岡田『生物学実験法講座 第8巻 A』p.31-33
- ^ アカガイなどはエリスロクルオリンを持つが、参考にした岡田『生物学実験法講座 第8巻 A』p31-33は古い資料でありエリスロクルオリンはヘモグロビンの近縁として同一視していると思われる。
- ^ この発明の記録には異論もある。-田中『顕微鏡の歴史』p.19-26
- ^ スワンメルダムらの報告は「赤い小球体」を見たことを報告したのみであり、赤血球の真の発見者はレーヴェンフックであると考える研究者もいる。-マックスウェル・M.ウイントローブ著『顕微鏡の歴史』西村書店、1981年 p.7-9
- ^ 後年の検証では分解能が3.5µm、あるいは検証者によっては 1µm に達していたと言われる-田中『顕微鏡の歴史』p.31-34
- ^ レーヴェンフックはスワンメルダムらの観察を知らなかったため、独力での発見である。ただし、レーヴェンフック自身は赤血球は本来は球状であると信じていたため、円盤状になっているのは観察時に何らかの要因で変形したのだと思っていた。
- ^ 血管は少量の一酸化窒素 (NO) の存在によって弛緩し拡張するが修飾Hb(ヘモグロビンそのものあるいは重合化など加工されたヘモグロビン、ここで言う剥き出しのヘモグロビン)は一酸化窒素 (NO) との高い親和度を持ち血管内皮から一酸化窒素 (NO) を奪い去ってしまうため、血管収縮による血圧の異常亢進や心筋梗塞があり、死亡率が明らかに高くなることが分かっている。-石塚「人工酸素運搬体の開発の現状」。余談になるが、体内で一酸化窒素 (NO) に変換される硝酸薬ニトログリセリンが狭心症の特効薬になるのは一酸化窒素 (NO) の血管拡張作用のためである。-出典、高久『新臨床内科学』p.243
出典
- ^ a b c d 杉本『内科学』p.1559
- ^ a b 小川『血液学』p.23
- ^ 小川『内科学書』p.35
- ^ a b c 杉本『内科学』p.1558
- ^ エヌ・ティー・エス『幹細胞の分化誘導と応用』p.3
- ^ 杉本『内科学』p.1560
- ^ 小川『内科学書』p.6
- ^ a b 三輪 『赤血球』p.7
- ^ 小川『内科学書』p.10
- ^ 野村『赤血球』p.30
- ^ 浅野『三輪血液病学』p.214-215
- ^ a b 菅原『血液のレオロジーと血流』p.24
- ^ 浅野『三輪血液病学』p.116
- ^ 浅野『三輪血液病学』p.214-218
- ^ 浅野『三輪血液病学』p.120-124
- ^ 浅野『三輪血液病学』p.214
- ^ a b c 浅野『三輪血液病学』p.49-50
- ^ 浅野『三輪血液病学』p.214-216
- ^ 野村『赤血球』p.47-61
- ^ 小川『内科学書』p.5
- ^ 野村『赤血球』p.22
- ^ a b c d 浅野『三輪血液病学』p.179
- ^ 小川『内科学書』p.12
- ^ a b c 浅野『三輪血液病学』p.117-118
- ^ a b c 三輪『赤血球』p.99-100
- ^ 浅野『三輪血液病学』p.234
- ^ 菅原『血液のレオロジーと血流』p.3
- ^ Robert K『ハーパー生化学』p.49
- ^ 八幡『細胞膜のしくみ』p.88-89
- ^ a b c d 三輪『赤血球』p.81-98
- ^ H. Lodish『分子細胞生物学』p.381
- ^ 八幡『赤血球膜研究史』p.260
- ^ a b Geoffrey『クーパー細胞生物学』p.49-51
- ^ a b c 浅島『図解分子細胞生物学』p.7-8
- ^ H. Lodish『分子細胞生物学』p.380
- ^ 浅島『図解分子細胞生物学』p.9
- ^ 八幡『細胞膜のしくみ』p.44-47
- ^ a b 八幡『細胞膜のしくみ』p.36-39
- ^ 八幡『赤血球膜研究史』p.258
- ^ 浅島『図解分子細胞生物学』p.9-10
- ^ 八幡『細胞膜のしくみ』p.48-50
- ^ a b 八幡『細胞膜のしくみ』p.58
- ^ 浅野『三輪血液病学』p.235
- ^ a b 野村『赤血球』p.45-46
- ^ 八幡『細胞膜のしくみ』p.86-91
- ^ H. Lodish『分子細胞生物学』p.403-404
- ^ 浅野『三輪血液病学』p.111-112
- ^ 野村『赤血球』p.46-47
- ^ 浅野『三輪血液病学』p.130
- ^ 日本検査血液学会『スタンダード検査血液学』初版 p.22
- ^ a b c d e 浅野『三輪血液病学』p.120-124
- ^ a b c d e f 浅野『三輪血液病学』p.242-244
- ^ 野村『赤血球』p.28
- ^ 浅野『三輪血液病学』p.121
- ^ 三輪『血液細胞アトラス』p.77
- ^ 浅野『三輪血液病学』p.2-4
- ^ 浅野『三輪血液病学』p.23-25
- ^ 浅野『三輪血液病学』p.31
- ^ 西田 朗「赤ちゃんは胎外の高酸素環境にどのように適応しているの?」『周産期医学』Vol.31 No.7、周産期医学編集委員会 編、東京医学社、2001年、pp872-874
- ^ a b 荻田幸雄、「HbF(ヘモグロビンF)」『産科と婦人科』Vol.43 No.4 p.413-415、診断と治療社、1976年 (有償閲覧)
- ^ a b 三輪『赤血球』p.119
- ^ 小林道頼、今井清博「ヘモグロビンの酸素平衡特性に秘められた意義-成人と胎児を比べて」『日本生理学雑誌』Vol.59 No.10、日本生理学会、1997年、pp.439-444
- ^ 小川『内科学書』p.8
- ^ 三輪 『赤血球』p.24
- ^ a b 浅野『三輪血液病学』p.244-245
- ^ 浅野『三輪血液病学』p.971
- ^ a b c 別府正敏,菊川清見、「細胞の脂質過酸化と老化」 油化学 1995年 44巻 10号 p.738-750, doi:10.5650/jos1956.44.738
- ^ 八幡『細胞膜のしくみ』p.158-162
- ^ 三輪『赤血球』p.74-79
- ^ 浅野『三輪血液病学』p.248
- ^ 日本検査血液学会『スタンダード検査血液学』初版p.5
- ^ 日本薬学会・HbA1c 2011.05.12閲覧
- ^ a b c 小川『内科学書』p.49
- ^ 杉本『内科学』p.1563
- ^ 塩崎宏子,泉二登志子、「鉄欠乏性貧血の検査と診断」 日本内科学会雑誌 2010年 99巻 6号 p.1213-1219, doi:10.2169/naika.99.1213
- ^ 浅野『三輪血液病学』p.184-186
- ^ 浅野『三輪血液病学』p.974-977
- ^ 浅野『三輪血液病学』p.189-194
- ^ a b 岡田『ギャノング生理学23版』p.613
- ^ 杉『人体機能生理学』p.305
- ^ 橋詰 明英, 鈴木 隆一, 横内 久猛 ほか、「赤血球自動識別アルゴリズムとその評価」 医用電子と生体工学 1990年 28巻 1号 p.25-32, doi:10.11239/jsmbe1963.28.25
- ^ 小松則夫、「真性赤血球増加症」 日本内科学会雑誌 2007年 96巻 7号 p.1382-1389, doi:10.2169/naika.96.1382
- ^ 田中龍二,藤村欣吾,岡田浩佑 ほか、「赤血球ピルビン酸キナーゼ欠乏および骨髄細胞染色体異常を伴った急性骨髄性白血病の1例」 臨床血液 1979年 20巻 2号 p.187-195, doi:10.11406/rinketsu.20.187
- ^ 菊池佑二、「赤血球変形能の測定と環境因子による変化」 日本バイオレオロジー学会誌 1992年 6巻 1号 p.2-16, doi:10.11262/jpnbr1987.6.1_2
- ^ メルクマニュアル・カリウム 2011.05.08閲覧
- ^ メルクマニュアル・高ビリルビン血症 2011.05.08閲覧
- ^ 浅野『三輪血液病学』p.4-5
- ^ 近江俊徳, 梶井英治, 小山田隆 ほか、「温式自己免疫性溶血性貧血患者における赤血球結合IgG量の測定とその意義」 日本輸血学会雑誌 1992年 38巻 5号 p.601-606, doi:10.3925/jjtc1958.38.601
- ^ a b 菅原『血液のレオロジーと血流』p.18-34
- ^ 浅野『三輪血液病学』p.133-134
- ^ a b c d e 浅野『三輪血液病学』p.51-53
- ^ a b 菅原『血液のレオロジーと血流』p.6-9
- ^ a b c 菅原『血液のレオロジーと血流』p.37
- ^ a b c d 越田『光学顕微鏡でみる比較動物学』p.58-59
- ^ a b c d 浅野『三輪血液病学』p.2031-2036
- ^ a b Nemi『最新・獣医血液学』p.71
- ^ a b c 関『実験動物の血液学』p.195-197
- ^ a b 菅原『血液のレオロジーと血流』p.32
- ^ Nemi『最新・獣医血液学』p.153
- ^ Terry W『鳥類とエキゾチックアニマルの血液学、細胞診』p.58-100
- ^ a b c Terry W『鳥類とエキゾチックアニマルの血液学、細胞診』p.8
- ^ a b 関『実験動物の血液学』p.13-19
- ^ a b Terry W『鳥類とエキゾチックアニマルの血液学、細胞診』p.58-100
- ^ a b c 岡田『生物学実験法講座 第8巻 A』p.31-33
- ^ a b 関『実験動物の血液学』p.5-7
- ^ a b c d 森岡清和 著『素顔の赤血球』p.122-124
- ^ 和合『動物の血液細胞と生体防御』p.129
- ^ a b c 田中『顕微鏡の歴史』p.19-26
- ^ 小林『世界の顕微鏡の歴史』p.160
- ^ a b 水上『赤血球の生化学』p.2
- ^ 水上『赤血球の生化学』p.104
- ^ ABO血液型の分子遺伝学 2011.05.07閲覧
- ^ 水上『赤血球の生化学』p.26-28
- ^ 水上『赤血球の生化学』p.28-29
- ^ 水上『赤血球の生化学』p.21
- ^ 水上『赤血球の生化学』p.34
- ^ 八幡『赤血球膜研究史』p.13-14
- ^ 石塚「人工酸素運搬体の開発の現状」
- ^ a b c 武田『人工赤血球のICU使用を目的とした最適化およびME技術の改良』p.1-2
- ^ a b 酒井「ヘモグロビン小胞体の開発の歴史と現状」
- ^ 堀之内「Hb小胞体の動物投与の成績」
参考文献
- 書籍
-
- 浅島誠、駒崎伸二 共著『図解分子細胞生物学』裳華房、2010年、ISBN 978-4-7853-5841-9
- 浅野茂隆、池田康夫、内山卓 監修『三輪血液病学』文光堂、2006年、ISBN 4-8306-1419-6
- エヌ・ティー・エス編『幹細胞の分化誘導と応用』エヌ・ティー・エス、2009年、ISBN 978-4-86043-160-0
- 岡田泰伸 監訳『ギャノング生理学』原書23版、丸善、2011年、ISBN 978-4-621-08319-2
- 岡田弥一郎 編『生物学実験法講座』 第8巻 A-体液生理実験法、中山書店、1954年
- 小川聡 総編集『内科学書』Vol.6 改訂第7版、中山書店、2009年、ISBN 978-4-521-73173-5
- 小川哲平、大島年照、浅野茂隆 編著『血液学』、中外医学社、1991年、ISBN 978-4-498-02544-8
- 越田豊、常木和日子 共著『光学顕微鏡でみる比較動物学』培風館、1994年、ISBN 4-563-07730-5
- 小林義雄 著『世界の顕微鏡の歴史』1980年
- 菅原基晃、前田信治共著『血液のレオロジーと血流』コロナ社、2003年、ISBN 4-339-07147-1
- 杉晴夫 編著『人体機能生理学』改訂第5版、南江堂、2009年、ISBN 978-4-524-25364-7
- 杉本恒明、矢崎義雄 総編集『内科学』第9版、朝倉書店、2007年、ISBN 978-4-254-32230-9
- 関正利 ほか編『実験動物の血液学』ソフトサイエンス社、1981年
- 高久史麿 ほか監修『新臨床内科学』第9版、医学書院、2009年、ISBN 978-4-260-00305-6
- 田中新一 著『顕微鏡の歴史』九州文庫出版社、1979年
- 武田純三 ほか著『人工赤血球のICU使用を目的とした最適化およびME技術の改良 : 平成21年度総括・分担研究報告書 : 厚生労働科学研究費補助金政策創薬総合研究事業』
- 寺野彰 総編集『シンプル内科学』南江堂、2008年、ISBN 978-4-524-22344-2
- 中山裕之『獣医学を学ぶ君たちへ』東京大学出版会、2019年、ISBN 978-4-130-72066-3
- 日本検査血液学会 編『スタンダード検査血液学』初版、医歯薬出版、2003年、ISBN 4-263-22271-7
- 日本生化学会 編『新生化学実験講座 6(上)』生体膜と膜輸送、東京化学同人、1992年、ISBN 4-8079-1071-X
- 野村武夫 編『赤血球』中外医学社、1994年、ISBN 4-498-02554-7
- 水上茂樹著『赤血球の生化学』第2版、東京大学出版会、1993年、ISBN 4-13-063209-4
- 三輪史朗監修『赤血球』医学書院、1998年、ISBN 4-260-10946-4
- 三輪史朗、渡辺陽之輔共著『血液細胞アトラス』第5版、文光堂、2004年、ISBN 978-4-8306-1417-0
- 森岡清和 著『素顔の赤血球』金原出版、1994年、ISBN 4-307-50513-1
- 八幡義人 著『赤血球膜研究史』医薬ジャーナル社、2007年、ISBN 978-4-7532-2238-4
- 八幡義人 著『細胞膜のしくみ』裳華房、2008年、ISBN 978-4-7853-8784-6
- 和合治久 編著『動物の血液細胞と生体防御』菜根出版、1997年、ISBN 4-7820-0133-9
- Geoffrey M.Cooper, Robert E.Hausman 著『クーパー細胞生物学』須藤和夫,他,訳、東京化学同人、2008年、ISBN 978-4-8079-0686-4
- H. Lodish, ほか著『分子細胞生物学』石浦章一他 訳、東京化学同人、2010年、ISBN 978-4-8079-0732-8
- Nemi C.Jain 著『最新・獣医血液学』作野幸孝 訳、LLLセミナー、1996年
- Robert K.Murray, Daryl K.Granner, Victor W.Rodwell著『ハーパー・生化学』上代淑人監訳、丸善、2007年、ISBN 978-4-621-07801-3
- Terry W.Campbell, Christine K.Ellis 著 『鳥類とエキゾチックアニマルの血液学、細胞診』斑目広郎訳、文永堂出版、2010年、ISBN 978-4-8300-3228-8
赤血球と同じ種類の言葉
- 赤血球のページへのリンク