シクロヘキサンの立体配座
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2021/10/04 04:15 UTC 版)
ナビゲーションに移動 検索に移動平らな正六角形の内角は120° であるが、炭素鎖における連続する結合間の望ましい角度は約109.5° (正四面体の中心と頂点を結ぶ直線のなす角)である。したがって、シクロヘキサン環は、全ての角度が109.5° に近づき、平らな六角形形状よりも低いひずみエネルギーを持つ特定の非平面立体配座を取る傾向にある。最も重要な形状はいす形、半いす形、舟形、ねじれ舟形である[3]。これらの立体配座の相対的安定性は、いす形 > ねじれ舟形 > 舟形 > 半いす形の順である。全ての相対的配座エネルギーについては後述する[4][3]。シクロヘキサン分子はこれらの立体配座間を容易に移ることができ、「いす形」と「ねじれ舟形」のみが純粋な形で単離することができる。
主要な配座異性体
いす形
いす形配座が最安定配座異性体である。25 °Cにおいて、シクロヘキサン溶液中の全分子の99.99%がこの配座を取る。
対称性はD3dである。全ての炭素中心は等価である。6つの水素中心はアキシアル位に立っており、C3軸に対しておおよそ平行である。6つの水素原子はC3対称軸に対して垂直に近い態勢である。これらの水素原子はそれぞれアキシアルおよびエクアトリアルと呼ばれる。
個々の炭素原子には1つの「上向き」水素と1つの「下向き」水素が付いている。隣接した炭素におけるC-H結合はねじれひずみがほとんどなくなるようにねじれ形配座を取っている。いす形構造は、水素原子がハロゲンや他の単純な基で置き換えられた時でも保存されることが多い。
アキシアルとエクアトリアル
いす形配座の環を構成する各炭素原子から伸びる電子軌道には大きく分けて2つの方向(垂直方向と横方向)が考えられる。垂直方向に伸びた電子軌道の先にある原子をアキシアル原子またはアキシアル位にある原子、横方向に伸びた電子軌道の先にある原子をエクアトリアル(エカトリアル)原子またはエクアトリアル位にある原子と呼ぶ。また、環を構成する炭素原子とアキシアル原子・エクアトリアル原子との間の原子間結合をそれぞれアキシアル結合、エクアトリアル結合とよぶ。シクロヘキサンの場合には各構成炭素原子にエクアトリアル水素とアキシアル水素がそれぞれ1つずつついている。垂直方向と横方向だけでなく、環を固定して考えたとき上側か下側かについても同様の向きとなるように電子軌道を持つ炭素原子は1個おきにあり、これらの電子軌道は互いに反発しあっている。
アキシアル・エクアトリアルはそれぞれ英語でaxial、equatorialと表記され、「軸 (axis)」および「赤道 (equator)」から派生した単語である。
1,3-ジアキシアル相互作用
アキシアル原子の電子半径が大きいと隣のアキシアル原子との反発力が大きくなるので、巨大な原子あるいは官能基は環反転によりエクアトリアル位に存在する場合が多い。たとえば、上図左側のメチルシクロヘキサンでは、3位のアキシアルにあるメチル基が1,5位のアキシアル水素と反発し、立体障害となるため、メチルシクロヘキサンの環反転の平衡は上図右側(巨大な官能基がエクアトリアルである状態)に傾く。この立体的な相互作用を1,3-ジアキシアル相互作用 (1,3-diaxial interaction) という。
舟形およびねじれ舟形
舟形
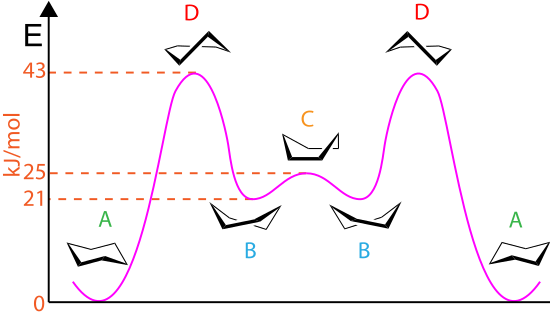
舟形配座はいす形配座よりも高いエネルギーを有する。具体的には、2つのフラッグポール位(旗ざお位、flagpole)水素間の相互作用が立体ひずみを生み出す。ねじれひずみも、重なり形配座を取るC2–C3およびC5–C6結合間に存在する。このひずみのため、舟形配置は不安定である(すなわち局所的エネルギー極小ではない)。シクロヘキサンにおいて舟形配座はいす形配座よりも29 kJ/mol不安定である。この値はシクロヘキサン中において、ある瞬間に舟形配座をとっている分子数はいす形配座をとっている分子数の14万分の1に過ぎないことを示している。
配座エネルギーの解析によれば、舟形配座はポテンシャルエネルギー面の極小点ではなく鞍点にあたる。すなわち配座同士の変換の遷移状態に相当する。実際に極小点となっているのはボートの舳先をそれぞれ環の円周方向に逆向きにひねった形のねじれ舟形(twist-boat、twisted-boat、skew-boat、skewed-boat、またはskew)と呼ばれる配座である。これはシクロヘキサンにおいては舟形配座よりも6 kJ/mol安定である。ねじれ舟形配座はD2対称性を有する。
普通、シクロヘキサン環においてはねじれ舟形配座よりもいす形配座の方が安定な配座であるが、cis-1,4-ジ-tert-ブチルシクロヘキサンのようにかさ高い置換基がある場合、これらの置換基がバウスプリット位にあるねじれ舟形配座の方が安定になる場合がある。
舟形配座の分子対称性はC2vである。
舟形の立体配座においては、ボートの胴体部分を構成する4つの炭素に結合している置換基のうち、環のおおよその平面に垂直の方向に出ている置換基を擬アキシアル位(ぎアキシアルい、pseudo-axial)にあるといい、平面内の方向へ出ている置換基を擬エクアトリアル位(pseudo-equatrial)にあるという。また、ボートの舳先にあたる炭素に結合している置換基のうち環の内側に出ている置換基をフラッグポール位(旗ざお位、flagpole)にあるといい、環の外側に出ている置換基をバウスプリット位(船首斜檣、bowsprit)にあるという。
ねじれ舟形
ねじれ舟形配座の対称性はD2(純粋回転点群)である。この配座は、舟形配座の2対のメチレン基の重なりを取り除くように分子をわずかにねじることによって誘導することができる。
室温においてねじれ舟形配座は全分子中の0.1%未満しか存在しないが、1073ケルビンでは30%に達する。シクロヘキサンの試料を1073 Kから40 Kまで急速に冷却すると、ねじれ舟形配座の大部分が固定される。これらは加熱していくといす形配座へとゆっくり変換する[5]。
動態
いす形–いす形
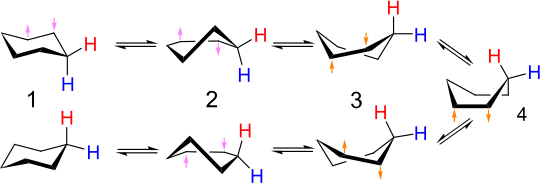
2つのいす形配座異性体の相互変換は環反転と呼ばれる。一方の配置においてアキシアルにある炭素-水素結合はもう一方ではエクアトリアルとなり、逆もまた同様である。室温で、2つのいす形配座は素早く平衡化する。シクロヘキサンのプロトンNMRスペクトルは室温で一重線である。
いす形–いす形相互変換の詳細な機構は多くの研究と議論の対象となってきた[6]。半いす形状態(下図のD)が、いす形配座とねじれ舟形配座との間の相互変換における重要な遷移状態である。半いす形はC2対称性を有する。2つのいす形配座環の相互変換は、いす形 → 半いす形 → ねじれ舟形 → 半いす形′ → いす形′ の順番で起こる:
ねじれ舟形–ねじれ舟形
舟形配座(下図C)は遷移状態であり、2つの異なるねじれ舟形配座環の相互変換を可能にしている。舟形配座はシクロヘキサンの2つのいす形配座環の相互変換には「必須」ではないが、そのエネルギーが半いす形のエネルギーよりもかなり低く、ねじれ舟形からいす形への変化に十分なエネルギーを持つ分子はねじれ舟形から舟形への変化に十分なエネルギーも持つため、この相互変換を説明するために使われる反応座標図に含められることが多い。したがって、ねじれ舟形配座にあるシクロヘキサンの分子が再びいす形配座に達する経路は複数存在する。
- ^ Eliel, Ernest Ludwig; Wilen, Samuel H. (2008). Stereochemistry of Organic Compounds. Wiley India. ISBN 978-8126515707
- ^ a b c Smith, Michael B.; March, Jerry (2007), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th ed.), New York: Wiley-Interscience, ISBN 0-471-72091-7
- ^ a b Nelson, Donna J.; Brammer, Christopher N. (2011). “Toward Consistent Terminology for Cyclohexane Conformers in Introductory Organic Chemistry”. J. Chem. Educ. 88 (3): 292–294. Bibcode: 2011JChEd..88..292N. doi:10.1021/ed100172k.
- ^ a b c J, Clayden (2003). Organic chemistry (2nd ed.). Oxford. pp. 373. ISBN 9780191666216
- ^ Squillacote, M.; Sheridan, R. S.; Chapman, O. L.; Anet, F. A. L. (1975-05-01). “Spectroscopic detection of the twist-boat conformation of cyclohexane. Direct measurement of the free energy difference between the chair and the twist-boat”. J. Am. Chem. Soc. 97 (11): 3244–3246. doi:10.1021/ja00844a068.
- ^ a b Gill, G.; Pawar, D. M.; Noe, E. A. (2005). “Conformational Study of cis-1,4-Di-tert-butylcyclohexane by Dynamic NMR Spectroscopy and Computational Methods. Observation of Chair and Twist-Boat Conformations”. J. Org. Chem. 70 (26): 10726–10731. doi:10.1021/jo051654z. PMID 16355992.
- ^ Bragg, W. H.; Bragg, W. L. (1913). “The structure of the diamond”. Nature 91 (2283): 557. Bibcode: 1913Natur..91..557B. doi:10.1038/091557a0.
- ^ Bragg, W. H.; Bragg, W. L. (1913). “The structure of the diamond”. Proc. R. Soc. A 89 (610): 277–291. Bibcode: 1913RSPSA..89..277B. doi:10.1098/rspa.1913.0084.
- ^ H. Sachse, Chem. Ber., 1890, 23, 1363; Z. Phys. Chem., 1892, 10, 203; Z. Phys. Chem., 1893, 11, 185–219.
- ^ E. Mohr, J. Prakt. Chem., 1918, 98, 315 and Chem. Ber., 1922, 55, 230.
- ^ This history is nicely summarized here:[1].
- 1 シクロヘキサンの立体配座とは
- 2 シクロヘキサンの立体配座の概要
- 3 置換誘導体
- 4 複素環類似体
- 5 参考文献
- シクロヘキサンの立体配座のページへのリンク