水素結合
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2024/02/19 01:21 UTC 版)
歴史
ライナス・ポーリングは著作 The Nature of the Chemical Bond の中で、1912年に水素結合について初めて述べた人物としてT. S. MooreとT. F. Winmillを挙げている[10]。MooreとWinmillは水素結合を、水酸化トリメチルアンモニウムが水酸化テトラメチルアンモニウムよりも弱い塩基であることを説明するために使用した。よりよく知られた状態である水における水素結合に関しては、少し遅れて1920年にウェンデル・ラティマーとウォース・ローデブッシュによって言及されている[11]。この論文において、ラティマーとローデブッシュは、彼らの研究室の研究員であるモーリス・ハギンズの未発表の成果を引用して、「未発表のいくつかの研究において本研究室のハギンズ氏は、ある有機化合物に関する理論として、2つの原子間の水素カーネルのアイデアを用いている。 "Mr. Huggins of this laboratory in some work as yet unpublished, has used the idea of a hydrogen kernel held between two atoms as a theory in regard to certain organic compounds."」と述べている[11]。
水における水素結合
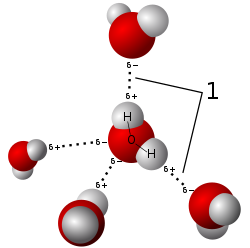
最も身近で、そしておそらく最も単純な水素結合の例は、水分子と水分子の間に見られる。個々の水分子には、2個の水素原子と1個の酸素原子が存在する。2つの分子しか存在しない最も単純な場合において、水2分子は1個の水素結合を形成できる。このような場合は、水二量体 (water dimer) と呼ばれ、しばしばモデルシステムとして用いられる。液体の水の場合のように、より多くの分子が存在する時は、水1分子の酸素原子は2つの非共有電子対を持ち、それぞれの非共有電子対が別の水分子の水素原子と1つの水素結合を形成できるため、より多くの水素結合を形成することが可能である。これが繰り返されることによって、図に示されているように、一つの水分子は4つまでの他分子と水素結合を形成できる。水素結合は氷の結晶構造に多大な影響を与えており、六方格子の構築に寄与している。氷の密度は同じ温度において水よりも小さく、故に、他のほとんどの物質とは異なり、水の固相状態は液体の水に浮く。
常温の空気中での燃焼において、水分子が発生した時は水素結合を生じ、直ちに液体になる。
液体の水の高い沸点は、低い分子量に比べて、それぞれの分子が多くの水素結合を形成できることが原因である。この水素結合ネットワークを壊すことが困難なため、水は他の水素結合を形成しない同様の液体と比較して、非常に高い沸点や融点、粘度を示す。水は、その酸素原子が2つの非共有電子対と2つの水素原子を持っているため、1つの水分子で4つまでの水素結合を形成できる点で特徴的である。例えば、フッ化水素は、フッ素原子が3つの非共有電子対と1つの水素原子を持っているが、水素結合を2つしか形成できない(アンモニアでは、3つの水素原子を持っているが1つの非共有電子対しかないという逆の問題がある)。
液体状態の水1分子が形成できる水素結合の厳密な数は、時間によって変動し、温度に依存する。TIP4Pモデルを用いた25 °Cにおけるシミュレーションでは、それぞれの水分子は平均して3.59個の水素結合に関与していると予測されている[12]。100 °Cでは、この数は分子運動の増大と密度の低下によって3.24個に減少するが、0 °Cでは水素結合の平均数は3.69個に増加する[12]。より最近の研究では、25 °Cにおける水素結合の数は2.357個とかなり少なく見積もられている[13]。この違いは、水素結合の定義と計測に異なる手法を用いているためではないかと考えられる。
水素結合の強さがより同等の時は、2つの相互作用してる水分子の原子は、2つの異なる電荷を持つ多原子イオン(水酸化物イオン OH− とヒドロニウムイオン H3O+)に分かれる。
実際に、標準状態における純粋な水では、このようなイオンの形成はほとんど起こらず、この状態における水の解離定数に従うと、5.5 × 108分子中で1分子のみである。これが水の特異性の最も重要な部分である。
水における二股状および過剰配位水素結合
単一の水素原子は1つではなく2つの水素結合に関与することができる。このようなタイプの水素結合は、二股状 (bifurcated) あるいは三中心型と呼ばれる。例えば、これらは天然あるいは合成有機分子の複合体中に存在している[14]。二股状水素結合は、水の再配向に必須の段階であることが示唆されている[15]。受容体型の水素結合(酸素原子の非共有電子対で終了する)は、供与体型(同じ酸素原子と結合した水素原子で始まる)よりも二股状水素結合を形成しやすい(過剰配位酸素、overcoordinated oxygen, OCO)[16]。
- ^ Felix H. Beijer, Huub Kooijman, Anthony L. Spek, Rint P. Sijbesma, E. W. Meijer (1998). “Self-Complementarity Achieved through Quadruple Hydrogen Bonding”. Angew. Chem. Int. Ed. 37: 75–78. doi:10.1002/(SICI)1521-3773(19980202)37:1/2<75::AID-ANIE75>3.0.CO;2-R.
- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). オンライン版: (2006-) "hydrogen bond".
- ^ E. Arunan, G. R. Desiraju, R. A. Klein, J. Sadlej, S. Scheiner, I. Alkorta, D. C. Clary, R. H. Crabtree, J. J. Dannenberg, P. Hobza, H. G. Kjaergaard, A. C. Legon, B. Mennucci and D. J. Nesbitt. “Definition of the Hydrogen Bond”. 2011年3月13日閲覧。
- ^ IUPAC Physical and Biophysical Chemistry Division (2011年11月10日). “Definition of the hydrogen bond”. Provisional Recommendations. 2011年3月13日閲覧。
- ^ Desiraju, G. R.; Steiner, T. (1999). The Weak Hydrogen Bond: in Structural Chemistry and Biology. ICUr monographs on crystallography 9. Oxford: Oxford Univ. Press. ISBN 978-0198502524
- ^ Campbell, Neil A.; Brad Williamson; Robin J. Heyden (2006). Biology: Exploring Life. Boston, Massachusetts: Pearson Prentice Hall. ISBN 0-13-250882-6
- ^ Emsley, J. (1980). “Very Strong Hydrogen Bonds”. Chem. Soc. Rev. 9: 91–124. doi:10.1039/cs9800900091.
- ^ Omer Markovitch and Noam Agmon (2007). “Structure and energetics of the hydronium hydration shells”. J. Phys. Chem. A 111 (12): 2253–2256. doi:10.1021/jp068960g. PMID 17388314.
- ^ A. C. Legon;D. J. Millen. (1987). Chem. Soc. Rev. 16: 467-498. doi:10.1039/CS9871600467.
- ^ Tom Sidney Moore and Thomas Field Winmill (1912). “CLXXVII.—The state of amines in aqueous solution”. J. Chem. Soc., Trans. 101: 1635. doi:10.1039/CT9120101635.
- ^ a b Wendell M. Latimer, Worth H. Rodebush (1920). “Polarity and ionization from the standpoint of the lewis theory of valence”. J. Am. Chem. Soc. 42 (7): 1419–1433. doi:10.1021/ja01452a015.
- ^ a b W. L. Jorgensen and J. D. Madura (1985). “Temperature and size dependence for Monte Carlo simulations of TIP4P water”. Mol. Phys. 56 (6): 1381. doi:10.1080/00268978500103111.
- ^ Jan Zielkiewicz (2005). “Structural properties of water: Comparison of the SPC, SPCE, TIP4P, and TIP5P models of water”. J. Chem. Phys. 123 (10): 104501. doi:10.1063/1.2018637. PMID 16178604.
- ^ Michel Baron, Sylviane Giorgi-Renault, Jean Renault, Patrick Mailliet, Daniel Carré et Jean Etienne (1984). “Hétérocycles à fonction quinone. V. Réaction anormale de la butanedione avec la diamino-1,2 anthraquinone; structure cristalline de la naphto [2,3-f] quinoxalinedione-7,12 obtenue”. Can. J. Chem. 62 (3): 526–530. doi:10.1139/v84-087.
- ^ Damien Laage and James T. Hynes (2006). “A Molecular Jump Mechanism for Water Reorientation”. Science 311 (5762): 832. doi:10.1126/science.1122154. PMID 16439623.
- ^ Omer Markovitch & Noam Agmon (2008). “The Distribution of Acceptor and Donor Hydrogen-Bonds in Bulk Liquid Water”. Molecular Physics 106: 485. doi:10.1080/00268970701877921.
- ^ a b R. H. Crabtree, Per E. M. Siegbahn, Odile Eisenstein, Arnold L. Rheingold, Thomas F. Koetzle (1996). “A New Intermolecular Interaction: UnconventionalHydrogen Bonds with Element−Hydride Bonds as ProtonAcceptor”. Acc. Chem. Res. 29 (7): 348–354. doi:10.1021/ar950150s.
- ^ E. D. Isaacs, A. Shukla, P. M. Platzman, D. R. Hamann, B. Barbiellini, and C. A. Tulk (1999). “Covalency of the Hydrogen Bond in Ice: A Direct X-Ray Measurement”. Phys. Rev. Lett. 82: 600-603. doi:10.1103/PhysRevLett.82.600.
- ^ Dingley, A. J.; Grzesiek, S. (1998). “Direct Observation of Hydrogen Bonds in Nucleic Acid Base Pairs by Internucleotide 2JNN Couplings”. J. Am. Chem. Soc. 120 (33): 8293–8297. doi:10.1021/ja981513x.
- ^ F. Cordier, M. Rogowski, S. Grzesiek and A. Bax (1999). “Observation of through-hydrogen-bond 2hJHC‘ in a perdeuterated protein”. J. Magn. Reson. 140 (2): 510–2. doi:10.1006/jmre.1999.1899. PMID 10497060.
- ^ Cordier, F.; Grzesiek, S. (1999). “Direct Observation of Hydrogen Bonds in Proteins by Interresidue 3hJNC‘ Scalar Couplings”. J. Am. Chem. Soc. 121 (7): 1601–1602. doi:10.1021/ja983945d.
- ^ “Law-breaking liquid defies the rules”. physicsworld.com (2004年9月24日). 2011年3月13日閲覧。
水素結合と同じ種類の言葉
- 水素結合のページへのリンク

