周期表
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2024/01/18 04:05 UTC 版)
分類
族
族(groupまたはfamily)は、周期表における縦方向の集合である。この族は元素を分類する上で最も重要な方法と考えられている。いくつかの族に当る各元素の特性は非常に似かよっており、原子量が多くなる方向で明らかな傾向が見られる。この族には名称がつけられているが、それらはアルカリ金属(alkali metals)、アルカリ土類金属(alkaline earth metals)、ニクトゲン(pnictogens)、カルコゲン(chalcogens)、ハロゲン(halogens)、貴ガス(noble gases)と、統一性があまり無い。第14族元素など周期表におけるその他の族は垂直方向での近似性があまり見られず、基本的に族の数字で表されることが多い。
現代の量子力学理論が要請する原子の構造は、族が持つ傾向で説明され、それは特性ごとに分ける上で最も重要な要素に影響を与える原子価殻において電子配置が同一である原子は同じ族に含まれる。同じ族の元素グループには原子半径・イオン化エネルギー・電気陰性度の傾向にも近似性が見られる。上から下に行くにつれ全体のエネルギー値が高くなるため、原子価電子は原子核から遠くなってゆき、元素の原子半径は大きくなる。原子全体が電子を捕まえる力は強くなるため、下に行くほどイオン化エネルギーは小さくなり、同様に原子核と原子価電子の距離が長くなるにつれ電気陰性度も低くなる[12]。
周期
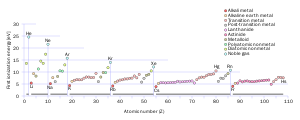
周期(period)は、周期表のおける横方向の集合である。基本的に各元素の特性に族で示される程の似かよった所は無いが、例外的な箇所もある。これは、遷移元素と、特にランタノイドやアクチノイドにおいて、水平方向で近似性を持つ特徴が相当する。この周期は、最外電子殻が内側から何番目であるかを表している[6]。
同じ周期にある元素は原子半径、イオン化エネルギー、電子親和力、電気陰性度のパターンで似た傾向を示す。左から右に行くにつれ、一般に原子半径は小さくなる。これは、元素に含まれる陽子の数は段々と増えるため、それに応じて電子が原子核にひきつけられるためである。これに伴ってイオン化エネルギーは大きくなり、貴ガスで最大となる[12]。原子半径が小さくなると全体を捉える力が強まり、電子を引き剥がすために必要なエネルギーが大きくなる。電気陰性度も同じく核による電子の牽引力が増すため大きくなる。電子親和力の周期内による変化傾向はわずかである。周期表左側にある金属元素は一般に、貴ガスを除いて右側の非金属元素よりも電子親和力は低い[12]。
ブロック
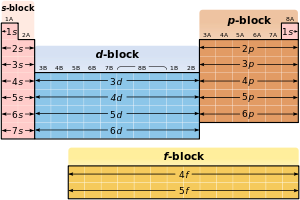
最外殻電子が元素の特徴に大きな影響を与える点を考慮して周期表を領域で分ける分類もあり、これはブロック(periodic table blockまたは単にblock)と呼ばれ、「最後の電子」が存在する亜殻の位置に応じて名称がつけられる。sブロック元素はアルカリ金属とアルカリ土類金属のふたつの族に水素とヘリウムが加わるブロックである。pブロック元素は残り6つの族(13–18族元素)が該当し、半金属はここに含まれる。dブロック元素は3-12族元素に当る遷移金属を包括する。通常、周期表の欄外に置かれるランタノイドとアクチノイドはfブロック元素となる。
その他
元素は他の集合でも分類され、周期表の縦横またはブロックでも示しにくい場合がある。金属・半金属元素と非金属元素の区分は暗示的にしか表現されない階段状の斜め線で区別されている。その線の右側が非金属元素、左側が金属元素であり、間に半金属が挟まれている。金属が持つ典型的特徴である電子を放出しやすい性質は、周期表の左下で強くなる[13]。
また、単体が常温常圧下で取る物質の状態(固体・液体・気体)もブロックでは表しにくい。全体の傾向は水素と右上のヘリウム付近(窒素から右、塩素から右および貴ガス)が気体であり、例外的に液体の相となる臭素と水銀とフランシウムを除いた元素は固体である。このような分類は、マスや文字色などそれぞれの周期表で工夫をこらした表現で示される場合もある[7]。
| 18 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 |
1 H |
2 | 13 | 14 | 15 | 16 | 17 | 2 He | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 |
3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 |
11 Na |
12 Mg |
3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | |||||||||||||||||||||||||||||||||||||||||
| 4 |
19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr | |||||||||||||||||||||||||||||||||||||||||
| 5 |
37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe | |||||||||||||||||||||||||||||||||||||||||
| 6 |
55 Cs |
56 Ba |
*1 | 72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn | |||||||||||||||||||||||||||||||||||||||||
| 7 |
87 Fr |
88 Ra |
*2 | 104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og | |||||||||||||||||||||||||||||||||||||||||
| 8 |
119 Uue |
120 Ubn |
*3 | 154 Upq |
155 Upp |
156 Uph |
157 Ups |
158 Upo |
159 Upe |
160 Uhn |
161 Uhu |
162 Uhb |
163 Uht |
164 Uhq |
165 Uhp |
166 Uhh |
167 Uhs |
168 Uho | |||||||||||||||||||||||||||||||||||||||||
| 9 |
169 Uhe |
170 Usn |
*5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6 |
*1 ランタノイド: | 57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu | |||||||||||||||||||||||||||||||||||||||||||
| 7 |
*2 アクチノイド: | 89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr | |||||||||||||||||||||||||||||||||||||||||||
| 8 |
*4 超アクチノイド: | 139 Ute |
140 Uqn |
141 Uqu |
142 Uqb |
143 Uqt |
144 Uqq |
145 Uqp |
146 Uqh |
147 Uqs |
148 Uqo |
149 Uqe |
150 Upn |
151 Upu |
152 Upb |
153 Upt | |||||||||||||||||||||||||||||||||||||||||||
| 8 |
*3 超アクチノイド: | 121 Ubu |
122 Ubb |
123 Ubt |
124 Ubq |
125 Ubp |
126 Ubh |
127 Ubs |
128 Ubo |
129 Ube |
130 Utn |
131 Utu |
132 Utb |
133 Utt |
134 Utq |
135 Utp |
136 Uth |
137 Uts |
138 Uto |
*4 | |||||||||||||||||||||||||||||||||||||||
| 9 |
*5 超アクチノイド: | 171 Usu |
172 Usb |
173 Ust |
[t 1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
- ^ a b c 米沢富美子「第11章 原子核物理学を築いた女性たち、元素周期表」『人物で語る物理入門(下)』(第1刷)岩波新書、2006年、112-116頁。ISBN 4-00-430981-6。
- ^ Whittaker, G. Allan; Mount, A. R.; Heal, M. R (2002), 中村 亘男 訳, ed., 物理化学キーノート, シュプリンガー・フェアラーク東京, 2002-12, p. 208, ISBN 4431709568
- ^ Andrews, Julian E.; Brimblecombe, Peter; Jickells, Tim D.; Liss, Peter. S.; Reid, Brian J.; 渡辺 正 訳 (2005), 地球環境化学入門, シュプリンガー・ジャパン, pp. 16, ISBN 9784431711117
- ^ “The periodic table of the elements” (英語). IUPAC. 2008年2月13日時点のオリジナルよりアーカイブ。2011年1月4日閲覧。
- ^ 竹内(1996)、pp.78-79
- ^ a b c d 大川(2002)、pp.44-48、1.7周期表と電子配置
- ^ a b ニュートン別冊(2010)、pp.30-31、周期表は140年もの間、重要な役割をになってきた
- ^ 新版元素ビジュアル図鑑(2016)、p.102
- ^ ニュートン別冊(2010)、pp.34-35、メンデレーエフの正しさは、原子構造で証明された
- ^ a b c d e 竹内(1996)、pp.76-83、5.1周期表
- ^ ニュートン別冊(2010)、pp.36-37、メンデレーエフを最後まで悩ませた元素の一群
- ^ a b c d 竹内(1996)、pp.83-91、5.2単体の性質の周期性
- ^ 大川(2002)、pp.52-55、1.9 イオン
- ^ a b c d e アシモフ(1967)、第8章 周期表、pp.155-161、乱雑に並んだ元素
- ^ a b ニュートン別冊(2010)、pp.26-27、元素の周期性に気づいた先人たち
- ^ a b c d アシモフ(1967)、第8章 周期表、pp.161-170、元素の体系化
- ^ 村上雅人 編著; 阿部泰之 ら (2004), 元素を知る事典 : 先端材料への入門, 東京: 海鳴社 (2004-11発行), p. 240, ISBN 487525220X
- ^ Newlands, John A. R. (1865-08-18). “On the Law of Octaves”. Chemical News 12: 83.
- ^ Bryson, Bill (2004). A Short History of Nearly Everything. London: Black Swan. pp. 141–142. ISBN 9780552151740
- ^ Sacks, Oliver W; 斉藤隆央 訳 (2003), タングステンおじさん: 化学と過ごした私の少年時代, 早川書房, ISBN 9784152085177
- ^ Ball, p. 101.
- ^ a b ニュートン別冊(2010)、pp.46-47、周期表を生み出したメンデレーエフの生涯
- ^ アイザック・アシモフ著; 小山慶太・輪湖博 訳 (1996), アイザック・アシモフの科学と発見の年表, 丸善, p. 261, ISBN 4621045377
- ^ a b c ニュートン別冊(2010)、pp.28-29、カードゲームでひらめいた!周期表の誕生物語
- ^ a b c 斉藤(1982)、2章 元素の種類と周期律、pp.35-39、2.1.4.メンデレーエフとマイヤー
- ^ a b アシモフ(1967)、第8章 周期表、pp.170-175、空所を埋める
- ^ 竹内(1996)、pp.97
- ^ a b アシモフ(1967)、第8章 周期表、pp.175-182、新しい元素の群
- ^ 斉藤(1982)、2章 元素の種類と周期律、pp.40-41、2.1.5.周期表の完成
- ^ 斉藤(1982)、2章 元素の種類と周期律、pp.47-51、2.2.3.アルゴンと貴ガス
- ^ “Dynamic periodic table” (英語). ptable.com. 2011年1月4日閲覧。
- ^ ニュートン別冊(2010)、pp.64-65、元素の基準はなぜ水素から炭素になったのか
- ^ a b ニュートン別冊(2010)、pp.42-43、水素の位置で新提案!周期表の並び方が変わる?
- ^ 「まんが アトム博士の科学探検」(東洋出版)60ページ・187ページ
- ^ a b c ニュートン別冊(2010)、pp.44-45、さまざまなタイプの周期表が考案されている
- ^ “Problem of the Week” (英語). Chemistry. 2011年1月4日閲覧。
- ^ “Reriodic Law can be understood in terms of the Tetrahedral Sphere Packing” (英語). perfectperiodictable.com. 2011年1月4日閲覧。
- ^ a b 坂根弦太、化学用語としての周期表の今昔物語(講座:化学の大学入試問題を考えるための基本) 化学と教育 Vol.58 (2010) No.4 p.190-193, doi:10.20665/kakyoshi.58.4_190
- ^ “周期律表”という言葉について
- ^ 三宅正二郎、関根幸男、金鍾得 ほか、ナノ周期積層膜の摩耗特性を活用したナノ加工技術の開発 精密工学会誌 Vol.66 (2000) No.12 P.1958-1962, doi:10.2493/jjspe.66.1958
- ^ TVクイズ番組『たけし・逸見の平成教育委員会』エンディングテーマ曲・二番歌詞
- ^ テレビアニメ『エレメントハンター』エンディングテーマ曲。
周期表と同じ種類の言葉
- 周期表のページへのリンク