G2期
G2期
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2023/03/11 02:53 UTC 版)
G2期(英: G2 phase、Gap 2 phase)は、細胞周期における間期の3番目の段階、つまりDNAの複製が行われるS期が正常に完了した後の段階、有糸分裂の直前の段階である。有糸分裂の第1段階である前期の開始によってG2期は終結する。
G2期は迅速な細胞成長とタンパク質合成が行われ、細胞が有糸分裂に備える段階である。G2期は細胞周期に必須の期間ではなく、一部の細胞種(特にツメガエルXenopusの初期胚[1]や一部のがん[2])はDNA複製から直接有糸分裂への進行が起こる。G2期とその後の有糸分裂への進行を調節する遺伝的ネットワークに関しては多くのことが知られているが、その重要性や調節、特にがんとの関係に関しては未解明の事項が多く存在する。G2期の細胞成長は、分裂酵母Schizosaccharomyces pombeでは、Cdr2を介したWee1活性の空間的調節によって制御されている[3]。しかし、Wee1は有糸分裂開始を負に調節する保存された因子であるものの、G2期に細胞のサイズの制御を行う一般的機構は未解明である。
生化学的には、成熟促進因子(MPF)としても知られる活性型のサイクリンB1/CDK1複合体が閾値レベルに到達したときにG2期は終結する[4]。この複合体の活性はG2期を通じて、緊密な調節を受けている。G2期チェックポイントは、DNA損傷に応答してCDK1を阻害的に調節し、細胞周期をG2期で停止させる。
相同組換えによる修復
S期に行われるDNA複製によって、ほぼ同一な姉妹染色分体が作り出される。複製の進行後またはG2期に生じたDNAの二本鎖切断は、細胞分裂(細胞周期のM期)が開始される前に修復が行われる。一方の姉妹染色分体に存在する二本鎖切断は、G2期の間に他方の姉妹染色分体を鋳型に用いた相同組換えによる修復が行われる[5]。
G2期の終結と有糸分裂の開始
有糸分裂の開始は、活性型のサイクリンB1/CDK1複合体(サイクリンB1/Cdc2複合体、または成熟促進因子(MPF)としても知られる)の閾値によって決定されている。活性型のサイクリンB1/CDK1複合体は、中心体の分離、核膜の解体、紡錘体の組み立てといった有糸分裂初期の不可逆的動作の引き金を引く。脊椎動物のサイクリンBには5つのアイソフォーム(B1、B2、B3、B4、B5)が存在するが、有糸分裂の開始においてそれぞれに特異的な役割が存在するかどうかは不明である。サイクリンB1はサイクリンB2の欠失を補償することが知られている(ショウジョウバエDrosophilaではその逆も起こる)[6]。出芽酵母Saccharomyces cerevisiaeには6つのB型サイクリン(Clb1–6)が存在するが、Clb2の機能が最も必要性が高い。脊椎動物とS. cerevisiaeの双方で複数のB型サイクリンが存在するのは、異なるサイクリンによってG2期からM期への移行の異なる側面を調節する、もしくは変動に対する移行過程のロバストネスを得るためであると考えられている[7]。
ここより下では、哺乳類細胞におけるサイクリンB1/CDKの時間的・場所的な活性化に焦点を当てるが、類似の経路は後生動物とS. cerevisiaeの双方に存在している。
サイクリンB1の合成と分解
サイクリンB1のレベルはG1期とS期を通じて後期促進複合体(APC/C)によって抑制されている。APC/CはサイクリンB1を分解標的とするE3ユビキチンリガーゼである。サイクリンB1の転写はDNA複製後のS期終盤に、G1期またはG1/S期サイクリン-CDK複合体によるNF-Yなどの転写因子のリン酸化に応答して開始される[8]。
サイクリンB1/CDK1活性の調節
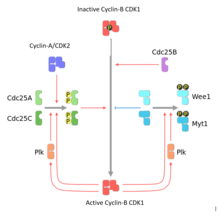
サイクリンB1のレベルの上昇に従って、サイクリンB1/CDK1複合体のレベルもG2期を通じて上昇する。しかし、Wee1とMyt1による阻害的なリン酸化のため、複合体はG2期からM期への移行前には不活性状態のままである。Wee1は主に核に局在してCDK1のチロシン15番(Tyr15)残基に作用し、Myt1は小胞体膜に固定されておりスレオニン14番(Thr14)にも作用する[9]。
Wee1とMyt1の作用はCdc25ファミリーのホスファターゼと拮抗する。Cdc25はCDK1の阻害的リン酸基を除去し、サイクリンB1/CDK1複合体を完全に活性化された形態(MPF)へ変換する[10]。
活性型のサイクリンB1/CDK1複合体は、Wee1とCdc25の活性を調節する。具体的には、CDK1によるリン酸化は、直接的にまたは中間キナーゼPLK1の活性化を介し、Wee1のキナーゼ活性の阻害とCdc25Cのホスファターゼ活性の活性化を行う[9]。そのため、CDK1はCdc25とポジティブフィードバックループを形成し、Wee1と二重のネガティブフィードバックループを形成する(全体としてはポジティブフィードバックループとなる)。
ポジティブフィードバックとスイッチ的な活性化
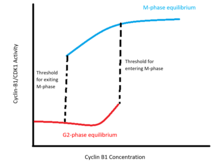
このポジティブフィードバックループによって、サイクリンB1のレベルに対するCDK1の活性はヒステリティックな双安定性を持つスイッチのような応答を示す。このスイッチによって、サイクリンB1の濃度がある特定の範囲にあるときには2つの異なる安定平衡状態が存在することになる。一方の平衡状態は間期の状態に対応するもので、サイクリンB1/CDK1複合体とCdc25が不活性状態であること、Wee1とMyt1の活性が高いことで特徴づけられる。もう一方の平衡状態はM期の状態に対応するもので、サイクリンB1/CDK1とCdc25の活性が高く、Wee1とMyt1の活性が低いことで特徴づけられる。この双安定性領域では、細胞の状態はその細胞が以前に間期であったかM期であったかによって決定される。M期への進行が起こる閾値となる濃度は、既に間期から脱出した細胞がM期を維持するために最低限必要な濃度よりも高い。
このG2期からM期への移行時の双安定性に対しては、理論的・実験的な検証が行われてきた。Novak-Tysonモデルによって、サイクリンB/CDK1-Cdc25-Wee1-Myt1からなるフィードバックループをモデル化した微分方程式から、サイクリンBが特定の濃度範囲にあるときに2つの安定平衡状態が生じることが示された[11]。実験的には、内在性のサイクリンB1の合成を停止させ、間期とM期の細胞へ非分解性のサイクリンB1をさまざまな濃度で滴定することで検証が行われた。その結果、M期への進行が起こる閾値濃度はM期を脱出する閾値濃度よりも高いことが示された。間期の細胞では核膜の解体はサイクリンB1が 32–40 nMの濃度に達した際に起こるのに対し、M期の細胞では 16–24 nM以上の濃度では核膜は解体されたままであった[12]。
このヒステリティックな双安定性スイッチは、少なくとも3つの理由から生理学的に必要である[13]。まず、G2期からM期への移行のシグナルによって染色体凝縮や核膜の解体といった細胞の形態に顕著な変化が生じるいくつかの過程が開始され、分裂中の細胞でなければ生存できない状態となる。そのため、サイクリンB1/CDK1の活性化はスイッチ的に起こることが必要不可欠である。つまり、移行後は迅速にM期の状態へと納まる必要があり、中間的で連続的な状態(核膜が部分的に解体された状態など)にとどまるべきではない。この要求はCDK1活性の間期とM期の間のシャープな非連続性によって解決されており、サイクリンB1の濃度が活性化の閾値を越えると、細胞は迅速にM期の平衡状態への切り替えを行う。
次に、G2期からM期への移行は一方向的に、細胞周期に一度だけ起こることが重要である。生物学的な系は本質的にノイズが大きいが、閾値付近でのサイクリンB1濃度の小さな変動によって間期とM期の間を行き来するようなことが起こってはならない。これもスイッチの双安定性によって保障されており、M期状態への移行が起こった後は、サイクリンBの濃度が少し低下したとしても間期への逆戻りは起こらない。
最後に、細胞周期が継続されるためにはサイクリンB1/CDK1の活性の持続的な振動が必要である。ネガティブフィードバックはこの長期的な振動に必須な要素の1つであり、サイクリンB1/CDKはAPC/Cを活性化することで中期以降でのサイクリンBの分解を引き起こし、CDK1を不活性状態にする。しかし、単純なネガティブフィードバックループで起こるのは減衰振動であり、最終的には定常状態へ落ち着くこととなる。しかし、ネガティブフィードバックループが双安定性ポジティブフィードバックループと組み合わされることにより、長期間の細胞周期に必要な持続的で非減衰型の振動(弛張発振)がもたらされることがモデリングから示されている。
ポジティブフィードバックの引き金
上述したサイクリンB1/CDK1がWee1とMyt1の阻害とCdc25の活性化によって自身を活性化するポジティブフィードバックループには、フィードバックループを開始させる「引き金」となる機構が含まれていない。近年、サイクリンA2/CDK複合体にこのスイッチを調節する重要な役割があることを示唆する証拠が得られた。サイクリンA2/CDK2の活性はS期の初期に出現し、G2期を通じて増大する。哺乳類細胞において、サイクリンA2のダウンレギュレーションはWee1の活性を増加させ、Plk1とCdc25Cの活性を低下させることでサイクリンB1/CDK1の活性化を遅らせる[7]。
場所的な調節
サイクリンB1/CDK1の活性化の双安定性とヒステリシスに加えて、タンパク質の細胞内局在の調節もG2期からM期への移行に寄与する。不活性型のサイクリンB1/CDK1は細胞質に蓄積し、その後、前期に迅速に核へ移行する。サイクリンB1/CDK1の核への移行は、アフリカツメガエルXenopus laevisでは、4つのセリン残基(S94、S96、S101、S113)のリン酸化によって活性化される。また、サイクリンB1の核外輸送は核外搬出シグナルのリン酸化によって不活性化される。これらのリン酸化部位の調節因子はいまだ多くが不明であるが、いくつかの因子は同定されており、ERK、PLK1、そしてCDK1自身である。Cdc25の細胞内局在も前期に細胞質から核へ変化する。これは核局在化シグナル近傍のリン酸基の除去と核外搬出シグナルのリン酸化によって行われる。Cdc25とサイクリンB1/CDK1が同時に輸送されることで、タンパク質の実効濃度が増加し、移行のスイッチ的な性質が増幅されていると考えられている[7]。
DNA損傷によるG2/M期の停止
損傷した染色体が分離されるのを防ぐため、G2期のDNA損傷や不完全な複製が行われた染色体に対し、細胞はG2期からM期への移行を遅らせることで対応する。DNA損傷はATMやATRといったキナーゼによって検出され、Cdc25を阻害するキナーゼのChk1を活性化する。Cdk1はCdc25の活性を直接的に、また核外搬出の促進によって阻害する[7]。これらの結果、M期へのヒステリティックな移行の開始に必要なサイクリンB1の閾値が高くなり、細胞は相同組換えなどの機構によって損傷が修復されるまで効率的にG2期で停止することとなる[4]。
G2期での停止の長期間の維持は、DNA損傷応答によって安定化されるp53によっても媒介される。CDK1はp53の転写標的であるp21、Gadd45、14-3-3σによって直接阻害される。p21によってサイクリンB1/CDK1は不活性型のまま核内に保持され[14]、活性型のサイクリンB1/CDK1は14-3-3σは細胞質に隔離される[15]。Gadd45はCDK1と直接相互作用することでサイクリンB1とCDK1の相互作用を阻害する。また、p53はCDK1の直接的な転写抑制も行う[15][16]。
医学との関係
G2期からM期への移行に関与するいくつかの遺伝子の変異は、多くのがんに関与することが示唆されている。サイクリンBとCDK1の双方の過剰発現は、多くの場合はp53などのがん抑制遺伝子の喪失の影響であるが、細胞増殖の増加を引き起こす[7]。CDK1の薬理学的阻害やsiRNAなどによるサイクリンB1の発現のダウンレギュレーションによって、これらの変化の実験的軽減を行うことができる[17][18]。
化学療法へ向けてG2期からM期への移行を調節する他の試みでは、DNA損傷チェックポイントに焦点が当てられている。Chk1の阻害による薬理学的なG2/M期チェックポイントの回避は、他の化学療法薬の細胞毒性を高めることが示されている。チェックポイントを回避することで有害な変異が迅速に蓄積し、がん細胞でアポトーシスが駆動されるためであると考えられている。逆に、G2/M期の停止を延長させる試みもドキソルビシンなどの薬剤の細胞毒性を高めることが示されている。これらのアプローチはまだ臨床または臨床前の研究段階である[19]。
出典
- ^ “An Overview of the Cell Cycle”. Molecular Biology of the Cell (4th ed.). New York: Garland Science. (2002). ISBN 978-0-8153-3218-3
- ^ “Absence of a measurable G2 phase in two Chinese hamster cell lines”. Proceedings of the National Academy of Sciences of the United States of America 74 (4): 1622–5. (April 1977). Bibcode: 1977PNAS...74.1622L. doi:10.1073/pnas.74.4.1622. PMC 430843. PMID 266201.)
- ^ “A spatial gradient coordinates cell size and mitotic entry in fission yeast”. Nature 459 (7248): 857–60. (June 2009). Bibcode: 2009Natur.459..857M. doi:10.1038/nature08074. PMID 19474789.
- ^ a b “Hysteresis drives cell-cycle transitions in Xenopus laevis egg extracts”. Proceedings of the National Academy of Sciences of the United States of America 100 (3): 975–80. (February 2003). Bibcode: 2002PNAS..100..975S. doi:10.1073/pnas.0235349100. PMC 298711. PMID 12509509.
- ^ “The management of DNA double-strand breaks in mitotic G2, and in mammalian meiosis viewed from a mitotic G2 perspective”. BioEssays 29 (10): 974–86. (October 2007). doi:10.1002/bies.20639. PMID 17876782.
- ^ “Cyclin B1 and CDK1: nuclear localization and upstream regulators”. Progress in Cell Cycle Research 5: 335–47. (2003). PMID 14593728.
- ^ a b c d e Morgan, David Owen, 1958- (2007). The cell cycle : principles of control. New Science Press. ISBN 978-0-19-920610-0. OCLC 70173205
- ^ “Cyclin-dependent kinase activation and S-phase induction of the cyclin B1 gene are linked through the CCAAT elements”. Cell Growth & Differentiation 8 (7): 811–20. (July 1997). PMID 9218875.
- ^ a b Schmidt, Matthias; Rohe, Alexander; Platzer, Charlott; Najjar, Abdulkarim; Erdmann, Frank; Sippl, Wolfgang (2017-11-23). “Regulation of G2/M Transition by Inhibition of WEE1 and PKMYT1 Kinases”. Molecules (Basel, Switzerland) 22 (12). doi:10.3390/molecules22122045. ISSN 1420-3049. PMC 6149964. PMID 29168755.
- ^ Strausfeld, U.; Labbé, J. C.; Fesquet, D.; Cavadore, J. C.; Picard, A.; Sadhu, K.; Russell, P.; Dorée, M. (1991-05-16). “Dephosphorylation and activation of a p34cdc2/cyclin B complex in vitro by human CDC25 protein”. Nature 351 (6323): 242–245. doi:10.1038/351242a0. ISSN 0028-0836. PMID 1828290.
- ^ “Numerical analysis of a comprehensive model of M-phase control in Xenopus oocyte extracts and intact embryos”. Journal of Cell Science 106 ( Pt 4): 1153–68. (December 1993). PMID 8126097.
- ^ “Hysteresis drives cell-cycle transitions in Xenopus laevis egg extracts”. Proceedings of the National Academy of Sciences of the United States of America 100 (3): 975–80. (February 2003). doi:10.1073/pnas.0235349100. PMC 298711. PMID 12509509.
- ^ “Building a cell cycle oscillator: hysteresis and bistability in the activation of Cdc2”. Nature Cell Biology 5 (4): 346–51. (April 2003). doi:10.1038/ncb954. PMID 12629549.
- ^ “p21-Mediated nuclear retention of cyclin B1-Cdk1 in response to genotoxic stress”. Molecular Biology of the Cell 15 (9): 3965–76. (September 2004). doi:10.1091/mbc.E03-12-0871. PMC 515331. PMID 15181148.
- ^ a b “Regulation of the G2/M transition by p53”. Oncogene 20 (15): 1803–15. (April 2001). doi:10.1038/sj.onc.1204252. PMID 11313928.
- ^ “p53 regulates a G2 checkpoint through cyclin B1”. Proceedings of the National Academy of Sciences of the United States of America 96 (5): 2147–52. (March 1999). Bibcode: 1999PNAS...96.2147I. doi:10.1073/pnas.96.5.2147. PMC 26751. PMID 10051609.
- ^ “The history and future of targeting cyclin-dependent kinases in cancer therapy”. Nature Reviews. Drug Discovery 14 (2): 130–46. (February 2015). doi:10.1038/nrd4504. PMC 4480421. PMID 25633797.
- ^ “Targeting cyclin B1 inhibits proliferation and sensitizes breast cancer cells to taxol”. BMC Cancer 8 (1): 391. (December 2008). doi:10.1186/1471-2407-8-391. PMC 2639606. PMID 19113992.
- ^ “To arrest or not to G(2)-M Cell-cycle arrest : commentary re: A. K. Tyagi et al., Silibinin strongly synergizes human prostate carcinoma DU145 cells to doxorubicin-induced growth inhibition, G(2)-M arrest, and apoptosis. Clin. cancer res., 8: 3512-3519, 2002”. Clinical Cancer Research 8 (11): 3311–4. (November 2002). PMID 12429616.
G2期
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2021/02/27 08:28 UTC 版)
DNA複製が完了してから、M期に入るまでの期間をG2期と呼ぶ。G2期では再び盛んなタンパク質合成が行われ、主に有糸分裂に必要な微小管が作られる。一般に間期の中ではG2期が最も短く、例えばヒトの細胞では多くの場合4~5時間で終了する。G2期にはG2/Mチェックポイントがあり、細胞がM期に進めるかどうか判断している。
※この「G2期」の解説は、「細胞周期」の解説の一部です。
「G2期」を含む「細胞周期」の記事については、「細胞周期」の概要を参照ください。
- G2期のページへのリンク