超酸化カリウム
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2023/05/27 08:13 UTC 版)
| 超酸化カリウム | |
|---|---|
 | |
Potassium dioxide | |
| 識別情報 | |
| CAS登録番号 | 12030-88-5 |
| PubChem | 61541 |
| RTECS番号 | TT6053000 |
| 特性 | |
| 化学式 | KO2 |
| モル質量 | 71.0971 g/mol |
| 外観 | 黄色固体 |
| 密度 | 2.14 g/cm3, 固体 |
| 融点 | 560 °C, 833 K, 1040 °F (分解) |
| 水への溶解度 | 分解 |
| 構造 | |
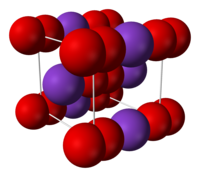
| 結晶構造 | 立方晶系 |
| 熱化学 | |
| 標準生成熱 ΔfH | -284.93 kJ mol-1[1] |
| 標準モルエントロピー S | 116.7 J mol-1K-1 |
| 標準定圧モル比熱, Cp | 77.53 J mol-1K-1 |
| 危険性 | |
| 主な危険性 | 腐食性、酸化性 |
| NFPA 704 | |
| Rフレーズ | R8 R14 R34 |
| Sフレーズ | S17 S27 S36/37/39 |
| 関連する物質 | |
| その他の陰イオン | 酸化カリウム 過酸化カリウム |
| その他の陽イオン | 超酸化ナトリウム |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
超酸化カリウム(ちょうさんかカリウム、英: potassium superoxide)はカリウムの超酸化物で、化学式はKO2 である。溶融したカリウムを純粋な酸素中で燃焼させて得られる。
性質
黄色の固体であり、結晶構造は立方晶系で炭化カルシウム型構造である。超酸化物イオンの不対電子のため常磁性を示す[2]。
反応と用途
超酸化カリウムは強力な酸化剤であり、また吸湿性もある。水分を吸収、酸化させ過酸化水素と酸素を生成する。
- 2 KO2 + 2 H2O → 2 KOH + H2O2 + O2[3]
水酸化カリウムは二酸化炭素と反応するほか吸湿性があり炭酸カリウム、炭酸水素カリウムへ変化する。
- 2 KOH + CO2 → K2CO3 + H2O
- KOH + CO2 → KHCO3
これらを合わせると最終的には次のようになる。
- 4 KO2 + 2 CO2 → 2 K2CO3 + 3 O2
- 4 KO2 + 4 CO2 + 2 H2O → 4 KHCO3 + 3 O2
- ( KO2 + CO2 + 1/2 H2O → KHCO3 + 3/4 O2 + 141.846kJ )
炭酸カリウムへ変化した場合理論上、超酸化カリウム1 kgあたり0.309 kgの二酸化炭素を吸収し、0.38 kgの酸素を放出する。
KO2 1molあたり1/2molのCO2,3/4molのO2をそれぞれ吸収、放出するともいえる。
炭酸水素カリウムへ変化させた場合はKO2 1molあたり1molのCO2を吸収できることになるが、実際にはCO2の供給濃度の問題、炭酸カリウムの潮解によって流路を塞いでしまう問題によってそこまで反応させることは難しく[4]、ソユーズの酸素発生器やしんかい2000向けに開発された生命維持装置では水酸化リチウムによる追加の二酸化炭素吸収を行う。[4]水酸化リチウム、超酸化カリウムに供給する流量をそれぞれ調整することで酸素濃度、二酸化炭素濃度を個別に制御できる。
十分に反応させるためには触媒の追加や粒径、形状の工夫もまた有効である。[4]
工業用酸化剤として二酸化炭素の除去や除湿に使われる。ロシア連邦宇宙局はソユーズの酸素発生器における酸素供給源として実用化され、非常用酸素マスクにも応用されている[5]。潜水艦・潜水服や消防服などの用途もあるが、水との反応性が高いため使用は限定的である。
二酸素誘導体の構造傾向
二酸素 (O2) の誘導体は、O-O 結合の結合次数と相関した特徴的な結合長をもつ。
| 二酸素誘導体 | 名称 | O-O 結合長 (Å) | O-O 結合次数 |
|---|---|---|---|
| O2+ | ジオキシゲニルカチオン | 1.12 | 2.5 |
| O2 | 二酸素 | 1.21 | 2 |
| O2- | スーパーオキシドアニオン | 1.28 | 1.5[6] |
| O22- | 過酸化物アニオン | 1.49 | 1 |
脚注
- ^ D.D. Wagman, W.H. Evans, V.B. Parker, R.H. Schumm, I. Halow, S.M. Bailey, K.L. Churney, R.I. Nuttal, K.L. Churney and R.I. Nuttal, The NBS tables of chemical thermodynamics properties, J. Phys. Chem. Ref. Data 11 Suppl. 2 (1982).
- ^ 化学大辞典. 共立出版. (1993)
- ^ Kumar De, Anil (2007). A Text Book of Inorganic Chemistry. New Age International. pp. 247. ISBN 978-8122413847
- ^ a b c “超酸化カリウム(KO2)を用いた潜水調査船用生命維持装置の基礎研究(その1) - 国立国会図書館デジタルコレクション”. dl.ndl.go.jp. 2020年10月28日閲覧。
- ^ “日本パイオニクス”. 2011年5月1日閲覧。
- ^ Abrahams, S. C.; Kalnajs, J. “The Crystal Structure of α-Potassium Superoxide” Acta Crystallographica (1955) 8, p503-506. DOI:10.1107/S0365110X55001540.
- 超酸化カリウムのページへのリンク