シャペロン【(フランス)chaperon】
シャペロン【chaperone】
シャペロン
シャペロンは、合成されたタンパク質の間違った折りたたみ(ミスフォールディング)を防ぐ。
タンパク質はアミノ酸が一つ一つつなげられて出来たポリペプチド鎖から出来ており、この鎖は自発的に折りたたまれていく(フォールディング)。しかし、巨大なタンパク質や複数のドメインを持ったタンパク質がコンパクトな形にたたまれる長い時間の間に、正しくフォールディングされなくなる場合もある。シャペロンは、そういったミスフォールディングが起きないように、ポリペプチド鎖と結合してフォールディングを介添えする。

CC Attribution-Noncommercial-Share Alike 3.0 Unported
シャペロン
シャペロン
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2024/02/02 09:17 UTC 版)
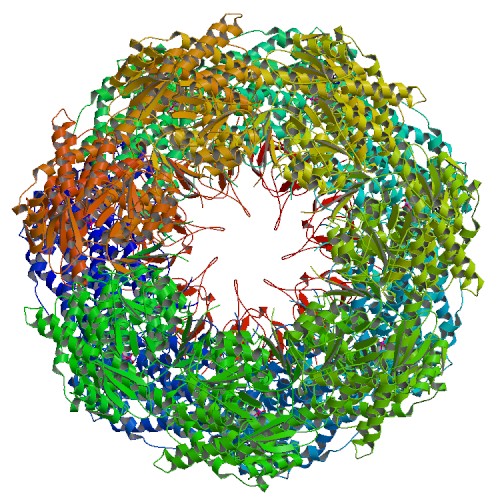
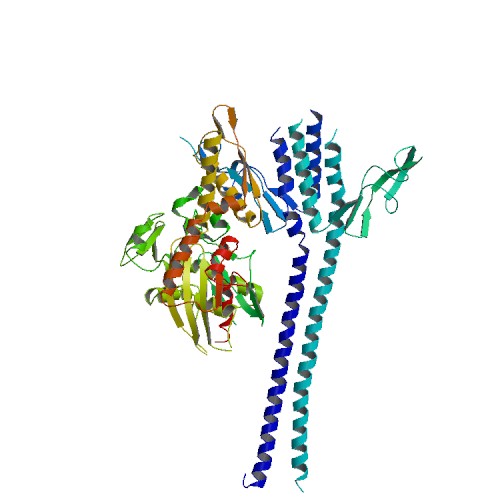
シャペロン(英: chaperone)とは、他のタンパク質分子が正しい折りたたみ(フォールディング)をして機能を獲得するのを助けるタンパク質の総称である。分子シャペロン(英: molecular chaperone)、タンパク質シャペロンともいう。
- ^ シャペロンの語源はフランス語の、中世ヨーロッパで頭部に着用した布や帽子を意味する用語であった。ここからどのような経緯があったかははっきりしていないが、19世紀末から20世紀初頭のイギリスにおいて、家事使用人の上級職の一つを指すようになった。その仕事内容は「若い未婚の女性が初めて社交界にデビューするときに社交の礼儀作法を指導する」というものであった。ここから転じて分子シャペロンという用語が誕生した。
- ^ Nenadらが大腸菌のトリガー因子と古細菌のリボソームサブユニットの複合体の結晶化を行った経緯は以下の通りである。彼らはトリガー因子の作用機序を推測するため複合体の結晶化してその構造を明らかにすることを求めた。理想は、トリガー因子もリボソームサブユニットも大腸菌のものを用いることであったが、当時、それはできなかった。なぜなら、結晶化されていたリボソームの大ユニットは唯一、古細菌のHaloarcula marismortuiのものであったためである。そこでNenadらはまず、大腸菌のトリガー因子を結晶化した。続いて、リボソームの結合部位が大腸菌と古細菌の間で保存されていることを期待して、異なる生物由来の二つのタンパク質を混合して結晶化させた。この方法は成功し、大腸菌のトリガー因子は古細菌のリボソームサブユニットと結合し、その状態での立体構造は明らかとなった。こうして、トリガー因子の作用機序について詳細に理論化されることとなった。
- ^ a b 町田幸大 (2015年4月25日). “分子シャペロン ~誕生の歴史と概念~”. 生物工学会誌2015 93: 213-215.
- ^ Robert F. Weaver (2008). ウィーバー分子生物学 第4版. 化学同人. pp. 933
- ^ Alexander Buchberger; Bernd Bukau; Thomas Sommer (22 October 2010). “Protein Quality Control in the Cytosol and the Endoplasmic Reticulum: Brothers in Arms”. Molecular Cell 40 (2): 238–252. doi:10.1016/j.molcel.2010.10.001.
- ^ William E. Balch; Richard I. Morimoto; Andrew Dillin; Jeffery W. Kelly (15 February 2008). “Adapting Proteostasis for Disease Intervention”. Science 319 (5865): 916–9.
- ^ Robert F. Weaver (2008). ウィーバー分子生物学 第4版. 化学同人. pp. 225
- ^ 今井亮三; 金明姫 (2014). “低温ショックドメインタンパク質の機能の保存性と多様性:植物からの視点”. 生化学 86 (4): 474–8.
- ^ 永田和宏 (2008). タンパク質の一生 ――生命活動の舞台裏. 岩波新書. pp. 74-75
- ^ a b Robert F. Weaver (2008). ウィーバー分子生物学 第4版. 化学同人. pp. 658-9
- ^ 永田和宏 (2008). タンパク質の一生 ――生命活動の舞台裏. 岩波新書. pp. 68
- ^ Lars Ferbitz; Timm Maier; Holger Patzelt; Bernd Bukau; Elke Deuerling; Nenad Ban (30 September 2004). “Trigger factor in complex with the ribosome forms a molecular cradle for nascent proteins”. Nature 431: 590–596. doi:10.1038/nature02899.
- ^ Rimma Belotserkovskaya; Sangtaek Oh; Vladimir A. Bondarenko; George Orphanides; Vasily M. Studitsky; Danny Reinberg (22 August 2003). “FACT Facilitates Transcription-Dependent Nucleosome Alteration”. Science 301 (5636): 1090-1093. doi:10.1126/science.1085703.
- ^ Laskey RA; Honda BM; Mills AD; Finch JT. “Nucleosomes are assembled by an acidic protein which binds histones and transfers them to DNA.”. Nature 275: 416-420. doi:10.1038/275416a0. PMID 692721.
- ^ William C. Earnshaw; Barry M. Honda; Ronald A. Laskey; Jean O. Thomas (September 1980). “Assembly of nucleosomes: the reaction involving X. laevis nucleoplasmin”. Cell 21 (2): 373–383.
- ^ Anfinsen CB (1973 Jul 20). “Principles that govern the folding of protein chains.”. Science 181 (4096): 223-230. doi:10.1126/science.181.4096.223. PMID 4124164.
- ^ P. Traub; M. Nomura (1968 Mar). “Structure and function of E. coli ribosomes. V. Reconstitution of functionally active 30S ribosomal particles from RNA and proteins.”. Proceedings of the National Academy of Sciences of the United States of America 59 (3): 777–784.
- ^ M. NOMURA; V. A. ERDMANN (21 November 1970). “Reconstitution of 50S Ribosomal Subunits from Dissociated Molecular Components”. Nature 228: 744-747. doi:10.1038/228744a0.
- ^ Klug A (1979). “The assembly of tobacco mosaic virus: structure and specificity”. The Harvey Lecture 74: 141-162.
- ^ Georgopoulos CP; Hendrix RW; Casjens SR; Kaiser AD (1973 May 5). “Host participation in bacteriophage lambda head assembly.”. J. Mol. Biol. 76 (1): 45–60. PMID 4578100.
- ^ Sternberg N (1973 May 5). “Properties of a mutant of Escherichia coli defective in bacteriophage lambda head formation (groE). II. The propagation of phage lambda.”. J. Mol. Biol. 76 (1): 25-44. PMID 4578099.
- ^ Zweig M; Cummings DJ (1973 Nov 5). “Cleavage of head and tail proteins during bacteriophage T5 assembly: selective host involvement in the cleavage of a tail protein.”. J. Mol. Biol. 80 (3): 505–518. PMID 4586985.
- ^ Hugh R.B. Pelham; Sean Munro (18 July 1986). “An hsp70-like protein in the ER: Identity with the 78 kd glucose-regulated protein and immunoglobulin heavy chain binding protein”. Cell 46 (2): 291–300. PMID 3087629.
- ^ Roger Barraclough; R.John Ellis (27 June 1980). “Protein synthesis in chloroplasts IX. Assembly of newly-synthesized large subunits into ribulose bishopshate carboxylase in isolated intact pea chloroplasts”. Biochimica et Biophysica Acta 608 (1): 19–31. doi:10.1016/0005-2787(80)90129-X.
- ^ Janet E. MUSGROVE; Richard A. JOHNSON; R. John ELLIS (1987). [http://onlinelibrary.wiley.com/doi/10.1111/j.1432-1033.1987.tb10900.x/pdf “Dissociation of the ribulosebisphosphate-carboxylase large-subunit binding protein into dissimilar subunits”]. Eur. J. Biochem. 163 (3): 529–534.
- ^ Ellis J. (1987 Jul 30-Aug 5). “Proteins as molecular chaperones.”. Nature 328 (6129): 378-9. PMID 3112578.
- ^ Hemmingsen SM; Woolford C; van der Vies SM; Tilly K; Dennis DT; Georgopoulos CP; Hendrix RW; Ellis RJ (1988 May 26). “Homologous plant and bacterial proteins chaperone oligomeric protein assembly.”. Nature 333 (6171): 330-4. doi:10.1038/333330a0. PMID 2897629.
- ^ THOMAS W. McMULLIN; RICHARD L. HALLBERG (Jan. 1988,). “A Highly Evolutionarily Conserved Mitochondrial Protein Is Structurally Related to the Protein Encoded by the Escherichia coli groEL Gene”. MOLECULAR AND CELLULAR BIOLOGY 8 (1): 371-380.
- 1 シャペロンとは
- 2 シャペロンの概要
- 3 分子内シャペロン
- 4 関連項目
シャペロン
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2021/07/10 14:02 UTC 版)
分子シャペロン (英: molecular chaperone) は、生体内 (in vivo) で他のタンパク質を正しく折りたたむのに役立つタンパク質の一種である。シャペロンは、すべての細胞内区画に存在し、ポリペプチド鎖と相互作用して、タンパク質の本来の三次元コンホメーションを形成できるようにする。ただし、シャペロン自体は、それらが補助しているタンパク質の最終構造には含まれていない。シャペロンは、新生ポリペプチドがリボソームによって合成されている場合でも、フォールディングを助けることができる。分子シャペロンは、結合することによって機能し、フォールディング経路でタンパク質の不安定な構造を安定化させるが、シャペロンには、それらが補助しているタンパク質の正しい本来の構造を知るために必要な情報は含まれておらず、むしろ、シャペロンは、誤った折りたたみ構造を防ぐことによって機能する。このように、シャペロンは実際には、本来の構造に向かうフォールディング経路に関与する個々のステップの速度を増加させることはなく、その代わりに、適切な中間体の探索を遅くする可能性のあるポリペプチド鎖の不要な凝集を減らすことで機能し、ポリペプチド鎖が正しいコンホメーションをとるためのより効率的な経路を提供する。シャペロンは、フォールディング触媒と混同されるべきではなく、フォールディング経路の遅いステップを実際に触媒する。フォールディング触媒の例は、タンパク質ジスルフィド異性化酵素(protein disulfide isomerases)およびペプチジルプロリル異性化酵素(peptidyl-prolyl isomerases)があり、それぞれジスルフィド結合の形成またはシスおよびトランス立体異性体間の相互変換に関与している可能性がある。シャペロンは、生体内でのタンパク質フォールディングのプロセスにおいて重要であることが示されている。なぜなら、シャペロンは、タンパク質が「生物学的に適切な」状態になるために十分効率的に適切な配列とコンホメーションをとるのに必要な手助けタンパク質に提供するからである。これは、in vitroで行われたタンパク質フォールディング実験で実証されたように、ポリペプチド鎖は理論的にはシャペロンの助けなしにその本来の構造に折りたたむことができることを意味するものであるが、このプロセスはあまりにも非効率的であるか、または遅すぎて生物学的システムには存在しないことが判明している。したがって、シャペロンは生体内でのタンパク質のフォールディングに必要である。シャペロンは、本来構造の形成を助ける役割に加えて、タンパク質の輸送、分解、さらには外部変性因子にさらされた変性タンパク質が正しい本来の構造にリフォールディング(再折りたたみ)する機会を与えるなど、様々な役割に関与していることが明らかになっている。 完全に変性したタンパク質は、三次構造と二次構造の両方を欠いており、いわゆるランダムコイルとして存在している。特定の条件下では、一部のタンパク質は再折りたたみ(リフォールド)する可能性があるが、多くの場合、変性は不可逆的である。細胞は、熱変性の影響からタンパク質を守るために、熱ショックタンパク質 (シャペロンの一種) として知られる酵素を用いて、他のタンパク質のフォールディングや折りたたまれた状態の維持を助けている。熱ショックタンパク質は、細菌からヒトにいたるまで、調査したすべての種で発見されており、非常に早い段階で進化し、重要な機能を持っていることが示唆されている。一部のタンパク質は、シャペロンの助けを借りて他のタンパク質との相互作用によりフォールディングが中断されないように個々のタンパク質を分離するか、誤って折りたたまれたタンパク質を展開して本来の正しい構造にリフォールディングをしない限り、細胞内では全く折りたたまれないことがある。この機能は、不溶性のアモルファス凝集体への沈殿のリスクを防ぐために非常に重要である。タンパク質の変性や天然状態の破壊に関与する外部要因には、温度、外部磁場 (電場、磁場)、分子クラウディング、さらにはタンパク質のフォールディングに大きな影響を与える可能性のある空間の制限 (すなわち閉じ込め) が含まれる。高濃度の溶質、極端なpH、機械的な力、化学的変性剤の存在も同様にタンパク質の変性に寄与する。これらの個々の要因はストレスとしてまとめて分類される。シャペロンは、細胞ストレス時には高濃度で存在し、変性タンパク質や誤って折りたたまれたタンパク質だけでなく、新生タンパク質の適切なフォールディングを助けることが示されている。 一部の条件下では、タンパク質は生化学的に機能する形に折りたたまれない。細胞が通常生存する温度範囲よりも高い温度や低い温度では、熱的に不安定なタンパク質は折りたたまれなかったり、変性する (これが煮沸すると卵白が不透明になる理由である)。しかし、タンパク質の熱安定性が一定であるとは限らない。例えば、超好熱性細菌は122 °Cの高温で生育することが確認されているが、これにはもちろん、重要なタンパク質やタンパク質集合体の完全な補体が、その温度以上で安定している必要がある。 大腸菌はバクテリオファージT4の宿主であり、ファージにコードされたgp31タンパク質は、大腸菌のシャペロンタンパク質 GroES(英語版)と機能的に相同であるように見え、感染時にバクテリオファージT4ウイルス粒子の組み立てにおいてそれを置き換えることができる。GroESと同様に、gp31はGroEL(英語版)シャペロニンとの安定な複合体を形成する。これはバクテリオファージT4メジャー・キャプシド・タンパク質gp23のin vivoでのフォールディングおよび組み立てに絶対的に必要である。
※この「シャペロン」の解説は、「フォールディング」の解説の一部です。
「シャペロン」を含む「フォールディング」の記事については、「フォールディング」の概要を参照ください。
シャペロン
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2022/05/21 00:22 UTC 版)
若い未婚の女性が外出する時、もしくは社交場に出る時に付き添いをした。多くは年配の婦人で社交の行儀作法が守られているかを監督する目付。
※この「シャペロン」の解説は、「家事使用人」の解説の一部です。
「シャペロン」を含む「家事使用人」の記事については、「家事使用人」の概要を参照ください。
固有名詞の分類
- シャペロンのページへのリンク